有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)写出A、B、C、D、E 5种元素的元素符号
A是________ B是________ C是________ D是________ E是________ (2)D元素在周期表中的位置为_________________________。
(2)D元素在周期表中的位置为_________________________。
(3)用电子排布式表示B元素原子的价电子构型_______________。
(4)元素的电负性的大小关系是B D,(填“>”、“<”或“﹦”),C与E的第一电离能的大小关系是C E(填“>”、“<”或“﹦”)。
(5)A2D属于 (填“极性”或“非极性”)分子,其分子的空间构型为 。
(6)D、E元素形成的化合物为 晶体,电子式为 。
有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
| 阳离子 |
K+ Na+ Cu2+ Al3+ |
| 阴离子 |
SO42- HCO3-NO3- OH- |
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,仅有B、C为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,只有A中放出无色气体,只有C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成。
根据上述实验填空:
(1)写出B、D的化学式:B____,D。
(2)将含lmol A的溶液与含l mol E的溶液反应后蒸干,仅得到一种化合物,该化合物化学式为___。
(3)C常用作净水剂,用离子方程式表示其净水原理_______。
(4)在A溶液中加入少量澄清石灰水,其离子方程式为____。
(5)向20mL 2mol/L C溶液中加入30mL E溶液,充分反应后得到0.78g沉淀,则E溶液的物质的量浓度可能是moI/L。
(8分)A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解.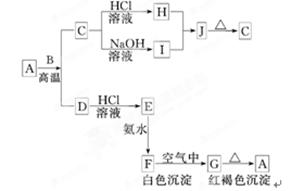
(1)写出下列物质的化学式:
A:________,E:________,J:________,G:________. (2)按要求写方程式:
A与B在高温条件下生成C和D的化学方程式:
______________________________________________________;
C转化为I的离子方程式:
2011年4月27日某市工商局查获400克袋装中老年补钙营养奶粉1 401包。这种奶粉被鉴定为所含亚硝酸盐残留量高出正常值7.8倍,长期食用可能致癌。已知NaNO2能发生如下反应:2NaNO2+4HI===2NO+I2+2NaI+2H2O。
(1)上述反应中氧化剂是________,若有0.75 mol的还原剂被氧化,则被还原的氧化剂有________ mol。
(2)根据上述反应,可以用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有①自来水;②淀粉碘化钾试纸;③淀粉;④白糖;⑤食醋;⑥白酒。进行实验时,必须选用的物质有__________。
(3)某厂废切削液中,含2%~5%的NaNO2,直接排放会造成污染,下列试剂中________(填序号)能使NaNO2转化为不引起二次污染的N2,反应的化学方程式为_____________________________________(并标出电子转移的数目和方向)。
①NaCl ②NH4Cl ③H2O2 ④浓H2SO4
已知A和B两支试管所盛的溶液中共含有K+、Ag+、Mg2+、Cl-、OH-、NO六种离子,向试管A的溶液中滴入酚酞试液呈粉红色。请回答下列问题:
(1)试管A的溶液中所含上述离子共有________种。
(2)若向某试管中滴入稀盐酸产生沉淀,则该试管为______(填“A”或“B”)。
(3)若向试管B的溶液中加入合适的药品,过滤后可以得到相应的金属和仅含一种溶质的溶液,则加入的药品是__________(填化学式)。
(4)若将试管A和试管B中的溶液按一定体积比混合过滤后,蒸干滤液可得到一种纯净物,则混合过程中发生反应的离子方程式为___________________________________、_________________。
(5)若试管A和试管B中的溶液是由等物质的量的四种物质配成的溶液,将两试管中溶液混合后过滤,所得滤液中各种离子的物质的量之比为________。
(6)若向由试管A溶液中的阳离子组成的碳酸氢盐溶液中,滴入少量Ba(OH)2溶液,则发生反应的离子方程式为________________
有一瓶澄清的溶液,其中可能含有H+、NH4+、Mg2+、Ba2+、Al3+、I-、NO3-、CO32-、SO42-、AlO2-,取该溶液进行以下实验:
(1)取pH试纸检验,溶液呈酸性,可以排除____________的存在。
(2)取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡后CCl4呈紫红色,可以排除____________的存在。
(3)另取出部分溶液逐渐加入NaOH溶液,使溶液从酸性逐渐变为碱性,反应过程中均无沉淀产生,则又可排除_____________的存在。
(4)取出部分上述碱性溶液加Na2CO3溶液后,有白色沉淀生成,证明有________的存在,又可以排除________的存在。
(5)根据上述实验事实可以确定,该溶液中肯定存在的离子是___________________,还不能确定是否存在的离子是________。