下列有关试剂的保存方法及性质描述错误的是 ( )
| A.浓硝酸保存在棕色的玻璃试剂瓶中 |
| B.实验室可用玻璃瓶盛放HF溶液 |
| C.冷的浓硫酸可以用铝罐储存 |
| D.新制氢氧化铜悬浊液可用于尿糖的检测 |
如下图所示,当向试管内通入21 mL O2时,最后试管中的液面仍在原来的位置,则原试管中NO为()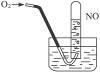
| A.6 mL | B.12 mL | C.16 mL | D.18 mL |
某金属单质跟一定浓度的硝酸反应,假定只产生单一的还原产物。当参加反应的单质与被还原的硝酸的物质的量之比为2∶1时,还原产物是()
| A.NO2 | B.NO | C.N2O | D.N2 |
把3体积NO2气体依次通过装有足量NaHCO3饱和溶液、浓H2SO4和Na2O2的3个装置,最后用排水法收集,假设氮的氧化物不与Na2O2反应,最后收集到_________________体积的气体,该气体的组成为________________。
下列氧化还原反应中,同一元素既被氧化又被还原的是()
| A.2NO+O2====2NO2 | B.N2+O2====2NO |
| C.N2+3H2====2NH3 | D.3NO2+H2O====2HNO3+NO |
下列叙述正确的是()
| A.氮族元素的气态氢化物均难生成,且均不稳定 |
| B.氮族元素单质只有磷存在同素异形体 |
| C.氮族元素的最高价氧化物对应的水化物均显强氧化性 |
| D.氮族元素均存在可变化合价 |