元素性质呈现周期性变化的根本原因是 ( )
| A.元素的相对原子质量递增,量变引起质变 |
| B.元素的原子半径呈周期性变化 |
| C.元素原子的核外电子排布呈周期性变化 |
| D.元素的化合价呈周期性变化 |
对于反应mA(g)+nB(g) pC(g)+qD(g) 满足下列图象,根据下列图象判断的四种关系正确的()

| A.m+n>p+q,正反应放热 | B.m+n>p+q,正反应吸热 |
| C.m+n<p+q, 正反应放热 | D.m+n<p+q,正反应吸热 |
在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的60%,则()
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的60%,则()
| A.a<b | B.平衡向逆反应方向移动了 |
| C.平衡向正反应方向移动了 | D.物质B的质量分数增加了 |
在密闭容器中进行如下反应:X2(g)+Y2(g)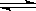 2 Z(g)。已知X2、Y2 Z的起始浓度分别为0.2mol/L、0.6mol/L、0.4mol/L,在一定条件下反应达到平衡,各物质的浓度有可能是()
2 Z(g)。已知X2、Y2 Z的起始浓度分别为0.2mol/L、0.6mol/L、0.4mol/L,在一定条件下反应达到平衡,各物质的浓度有可能是()
| A.X2为0.4mol/L | B.Y2为0.4mol/L | C.Z为0.6mol/L | D.Z为0.8mol/L |
过量的锌粉跟100mL 6mol/L H2SO4反应,在一定温度下,为了减缓反应速率但又不影响生成氢气的总量。加入下列物质不能达到上述目的的是()
| A.把锌粉改为锌粒 | B.水 | C.Na2CO3固体 | D.降低反应体系温度 |
在温度压强不变的情况下,已知N2O4 2NO2,2mol N2O4在密闭容器内分解成NO2,到达平衡时生成了0.6mol NO2,则平衡时气体的总物质的量是()
| A.0.6mol | B.1.8mol | C.2.2mol | D.2.3mol |