某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到沉淀。
甲同学认为两者反应只生成CuSO3一种沉淀;
乙同学认为这两溶液能相互促进水解,生成气体和Cu(OH)2一种沉淀;
丙同学认为同时生成CuCO3和Cu(OH)2两种沉淀。(已知:CuCO3和Cu(OH)2均不带结晶水)
I(1)写出Na2CO3溶液水解的离 子方程式 ;
子方程式 ;
(2)在探究沉淀物成分前,须将沉淀从溶液中分离并净化。具体操作为: (填操作名称)、干燥。
Ⅱ.请用右图所示装髓,选择必要的试剂,进行定性探究生成物的成分。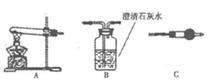
(1)各装置连接顺序为 → →
→ 。
。
(2)装置C中装有试剂的名称是 。
(3)能证明生成物中有CuCO3的实验现象是 。
Ⅲ.若CuCO3和Cu(OH)2两者都有,可通过下列装置的连接,进行定量分析来测定其组成。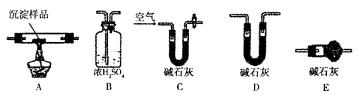
(1)装置c中碱石灰的作用是
(2)实验开始时和实验结束时都要通人处理过的过量空气,其作用分别是:
 。
。
(3)若沉淀样品的质量为m g,装置B质量增加了n g,则沉淀中CuCO3岛的质量分数为 ×100%。
ClO2作为一种广谱型的消毒剂,将逐渐用来取代Cl2成为自来水的消毒剂.已知ClO2是一种易溶于水而难溶于有机溶剂的气体,实验室制备ClO2的原理是用亚氯酸钠固体与纯净的氯气反应 2NaClO2+Cl2═2ClO2+2NaCl。如图1是实验室用于制备和收集一定量纯净的ClO2的装置(某些夹持装置和垫持用品省略).其中E中盛有CCl4液体。
(1)仪器P的名称是
(2)写出装置A中烧瓶内发生反应的化学方程式:
(3)E装置中所盛试剂的作用是
(4)F处应选用的收集装置是图2 (填序号),其中与E装置导管相连的导管口是图2 (填接口字母).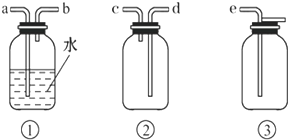
(5)以下是尾气吸收装置,能用于吸收多余ClO2气体,并能防止倒吸的装置的是如图3的
A.①② B.②③C.③④ D.②④
(6)若用100mL 2mol•L﹣1的浓盐酸与足量的MnO2制备Cl2,则被氧化的HCl的物质的量是 (填序号).
A.>0.1mol B.0.1mol C.<0.1mol D.无法判断.
(7)ClO2也可由NaClO3在H2SO4溶液存在下与Na2SO3反应制得.请写出反应的化学方程式: .
(每空2分,共14分)为了测定氢氧化钠和碳酸钠固体混合物m g中碳酸钠的质量分数,甲、乙两位同学分别设计了如下的实验方案:
(1)甲同学的方案是:将样品溶解,加入过量1mol·L-1氯化钡溶液,过滤洗涤,取沉淀烘干,称量得固体n g。则混合物中碳酸钠的质量分数为____________;能否用过量的1mol·L-1氯化钙溶液代替氯化钡溶液来测定碳酸钠的质量分数____ ___(填“能”或“否”),理由_____ 。
(2)乙同学的方案是:将样品溶解后,加入稍过量的氯化钡溶液,再滴入2—3滴酚酞试液,用标准盐酸滴定。乙同学在滴定过程中所需要的主要玻璃仪器有___________,滴定终点时的现象是____________,加入过量氯化钡溶液的目的是____________;判断氯化钡过量的方法是_____。
三氯化磷(PCl3)是一种重要的有机合成催化剂。实验室常用红磷与干燥的Cl2制取PCl3,装置如下图所示。
已知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇O2会生成POCl3(三氯氧磷), POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl。PCl3、POCl3的熔沸点见下表。
| 物质 |
熔点/℃ |
沸点/℃ |
| PCl3 |
-112 |
75.5 |
| POCl3 |
2 |
105.3 |
请答下面问题:
(1)B中所装试剂是 ,F中碱石灰的作用是 。
(2)实验时,检查装置气密性后,向D装置的曲颈甑中加入红磷,打开K3通入干燥的CO2,一段时间后,关闭K3,加热曲颈甑至上部有黄色升华物出现时通入氯气,反应立即进行。通干燥CO2的作用是 ,
(3)实验制得的粗产品中常含有POCl3、PCl5等。加入红磷加热除去PCl5后,通过 (填实验操作名称),即可得到较纯净的PCl3。
(4)C装置中的K1、K2的设计也出于类似的目的,为了达到这一实验目的,实验时与K1、K2有关的操作是 。
(5)实验后期关闭K1,打开K2,将气体通入C装置中发生反应,反应后的溶液为X。某同学设计实验来确定溶液X中含有的某些离子,请补充完成实验步骤和现象。
| 实验步骤 |
实验现象 |
实验结论 |
| ① |
溶液X中含有Na+ |
|
| ② |
溶液X中含有Cl- |
(6)玻璃管之间的连接需要用到胶皮管,连接的方法是:先把 ,然后稍稍用力即可把玻璃管插入橡皮管。甲同学将装置A的示意图画成右图,该示意图中明显的错误是 。
实验室用密度为1.25 g·mL-1,质量分数为36.5%的浓盐酸配制240 mL 0.1 mol·L-1的盐酸,请回答下列问题:
(1)浓盐酸的物质的量浓度为______________。
(2)配制240 mL 0.1 mol·L-1的盐酸应量取浓盐酸体积________ mL,应选用容量瓶的规格为________mL。
(3)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)________。
| A.用30 mL水洗涤2~3次,洗涤液均注入容量瓶,振荡 |
| B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30 mL),用玻璃棒慢慢搅动,使其混合均匀 |
| C.将已冷却的盐酸沿玻璃棒注入容量瓶中 |
| D.将容量瓶盖紧,振荡,摇匀 |
E.改用________加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线________处
(4)操作A中,将洗涤液都移入容量瓶,其目的是 。
实验室用63%的浓HNO3(其密度为1.4g/mL)配制240mL 0.50mol/L稀HNO3,若实验仪器有:A.10mL量筒 B.50mL量筒 C.托盘天平 D.玻璃棒 E.100mL容量瓶 F.250mL容量瓶 G.500mL容量瓶 H.胶头滴管 I.200mL烧杯.
(1)此浓硝酸的物质的量浓度为 mol/L
(2)应量取63%的浓硝酸 _________mL,应选用 。(填仪器的字母编号)
(3)实验时还需选用的仪器有(填序号) D、I、
(4)配制过程中,下列操作会使配制的稀硝酸溶液浓度偏高的是 (填序号) 。
①量取浓硝酸的量筒用蒸馏水洗涤2-3次,并把洗涤液转入容量瓶
②容量瓶使用时未干燥
③溶解后未经冷却就移液
④定容时不小心有少量蒸馏水滴到瓶外
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
(5)容量瓶是一种颈部细长的梨形瓶,由于其颈部细长,所以在向容量瓶中移入液体时,需要一定的耐心和技巧。有人建议将容量瓶的瓶颈改粗,对该建议的正确评价是( )
A.可以按此建议改进,便于使用容量瓶
B.不能按此建议改进,因为会降低容量瓶的精确度
C.不必加粗瓶颈,因为向容量瓶中转移液体时,有少量液体倒出瓶外,不会对溶液的浓度产生太大影响
(6)取所配制的稀硝酸100 mL,与一定质量的铜充分反应,铜全部溶解后,生成NO气体在标准状况下的体积为0.224 L,若反应后溶液中的H+浓度为0.1mol/L(设反应后溶液的体积仍为100 mL),则参加反应的铜的质量为 g。