现有Cu和Cu2O的混合物,将其分成两等份。一份用足量氢气还原,测得反应后固体质量减少8.0g;另一份加入500 mL稀硝酸,固体恰好完全溶解,且收集到标准 状况下8.96LNO(假定无其它气体生成)。则所用硝酸的物质的量浓度为 ( )
状况下8.96LNO(假定无其它气体生成)。则所用硝酸的物质的量浓度为 ( )
| A.3.2 mol/L | B.4.4mol/L | C.5.2mol/L | D.6.0mol/L |
下列实验操作、现象和结论均正确的是
| 选项 |
实验操作 |
现象 |
结论 |
| A |
SO2通入溴水中 |
溶液褪色 |
SO2有漂白性 |
| B |
将Fe(NO3)2样品溶于稀H2SO4,滴加KSCN溶液 |
溶液变红 |
Fe(NO3)2样品已氧化变质 |
| C |
将新制氯水和KI溶液在试管中混合后,加入CCl4,振荡静置 |
溶液分层,下层呈紫色 |
氧化性:Cl2>I2 |
| D |
分别向0.1 mol·L-1醋酸和饱和硼酸溶液中滴加0.1mol·L-1Na2CO3溶液 |
醋酸中有气泡产生,硼酸中没有气泡产生 |
酸性:醋酸>碳酸>硼酸 |
【改编】常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中不正确的是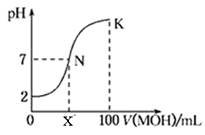
| A.HA一定为一元强酸 |
| B.若x>50,则MOH为一元弱碱 |
| C.N点溶液中:c(A-)=c(M+)>c(OH—)=c(H+) |
| D.若K点对应的溶液的pH=12,则K点溶液中水的电离程度大于0.01 mol·L-1HA溶液中水的电离程度 |
某小组进行电化学研究,甲同学设计如下图的装置图,乙同学利用甲的装置和桌面其他的药品与材料,不能完成的实验是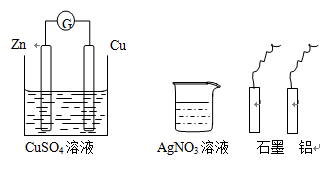
| A.使甲同学的正极变为负极 | B.设计一个新的原电池 |
| C.在碳电极上镀锌 | D.使锌电极受到保护 |
【原创】设NA为阿伏伽德罗常数的数值。下列说法正确的是
| A.78g苯中C—C和C=C的个数均是3NA |
| B.标准状况下,NA个SO3分子的体积约是22.4L |
| C.Na与氧气化合生成0.1molNa2O2转移0.4NA个电子 |
| D.常温下,1L 0.1mol·L—1的Na2S溶液中的阴离子数目大于0.1NA |
下列叙述I和II均正确且具有因果关系的是
| 编号 |
叙述I |
叙述II |
| A |
金属活动性铜比铁弱 |
镀铜铁制品表层划损后仍然受到保护 |
| B |
金属钠有还原性 |
用金属钠检验无水乙醇中是否含有少量水 |
| C |
Ksp(CaCO3)<Ksp(CaSO4) |
用Na2CO3溶液和盐酸除水垢CaSO4 |
| D |
Cl2具有漂白性 |
用氯气制盐酸 |