研究小组发现一种化合物在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4 min~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是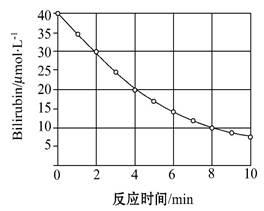
| A.2.5 μmol·L-1·min-1和2.0 μmol·L-1 |
| B.2.5 μmol·L-1·min-1和2.5 μmol·L-1 |
| C.3.0 μmol·L-1·min-1和3.0 μmol·L-1 |
| D.5.0 μmol·L-1·min-1和3.0 μmol·L-1 |
用石墨作电极,电解lmol/L下列物质的溶液,溶液的PH保持不变的是()
| A.HCl | B.NaOH | C.Na2SO4 | D.NaCl |
已知下列热化学方程式:Zn(s)+1/2O2(g)=ZnO(s)ΔH1="—351.1" kJ/mol ;
Hg(l)+1/2O2(g)=HgO(s)ΔH2="—90.7" kJ/mol 。
由此可知Zn(s)+HgO(s)="==" ZnO(s)+Hg(l)△H3。其中△H3的值是()
| A.—441.8kJ/mol | B.—254.6kJ/mol | C.—438.9kJ/mol | D.—260.4kJ/mol |
已知热化学方程式:2SO2(g)+ O2(g)  2SO3(g)△H = ―196.64kJ/mol
2SO3(g)△H = ―196.64kJ/mol
在容器中充入2molSO2和1molO2充分反应,最终放出的热量为 ( )。
| A.196.64kJ | B.196.64kJ/mol | C.< 196.64kJ | D.> 196.64kJ |
已知在1×105Pa、298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化
学方程式正确的是( )
A.H2O(g)=H2(g)+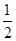 O2(g); O2(g); H= +242kJ·mol-1 H= +242kJ·mol-1 |
B.2H2(g)+O2(g) = 2H2O(l); H= -484kJ·mol-1 H= -484kJ·mol-1 |
C.H2(g)+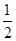 O2(g)=H2O(g); O2(g)=H2O(g); H= +242kJ·mol-1 H= +242kJ·mol-1 |
D.2H2(g)+O2(g)=2H2O(g); H="+" 484kJ·mol-1 H="+" 484kJ·mol-1 |
哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充人1mol N2和 3mol H2,在一定条件下发生反应N2(g)+3H2(g)
3mol H2,在一定条件下发生反应N2(g)+3H2(g) 2NH3(g),下列有关说法正确的是()。
2NH3(g),下列有关说法正确的是()。
| A.达到化学平衡时,N2将完全转化为NH3 |
| B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 |
| C.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 |
| D.达到化学平衡时,正反应和逆反应的速率都为零 |