某温度下,浓度都是1 mol·L-1的两种气体X2和Y2,在密闭容器中反应生成气体Z,经过t min后,测得物质的浓度分别为:c(X2)=0.4 mol·L-1,c(Y2)=0.8 mol·L-1,c(Z)=0.4 mol·L-1,则该反应的反应式可表示为:
A.X2+2Y2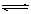 2XY2 2XY2 |
B.2X2+Y2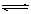 X2Y X2Y |
C.3X2+Y2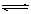 2X3Y 2X3Y |
D.X2+3Y2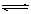 2XY3 2XY3 |
以下关于化学实验中“先与后”的说法中正确的是( )
①加热试管时,先均匀加热,后局部加热;
②用排水法收集气体时,先移出导管后撤酒精灯;
③制取物质时,先检查装置气密性后装药品;
④使用容量瓶、分液漏斗、滴定管前,先检查是否漏水后洗涤干净;
⑤做H2还原CuO实验时,先加热CuO后通H2;反应完毕后,先撤酒精灯待试管冷却后停止通H2。
⑥天平在使用前应该先调零,再称量物质的质量。
| A.除②以外 | B.除④以外 | C.除⑤以外 | D.全部正确 |
为了除去粗盐中Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作。其中不正确的操作顺序是()
①过滤②加过量的NaOH溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液
| A.⑤②④①③ | B.④①②⑤③ | C.②⑤④①③ | D.⑤④②①③ |
下列各组物质的分类正确的是()
①混合物:氯水、氨水、水玻璃、水银、福尔马林、淀粉②含有氧元素的化合物叫氧化物,
③CO2、NO2、P2O5均为酸性氧化物,Na2O、Na2O2为碱性氧化物 ;
④同位素:1H+、2H2、3H
⑤同素异形体:C60、C80、金刚石、石墨;
⑥糖类、油脂、蛋白质都是高分子化合物,它们都能发生水解反应。
⑦同分异构体:乙二酸二乙酯、乙二酸乙二酯
⑧强电解质溶液的导电能力一定强
⑨在熔化状态下能导电的化合物为离子化合物
⑩有单质参加的反应或有单质产生的反应是氧化还原反应。
| A.全部正确 | B.①②⑤⑦⑨ | C.②⑤⑥⑦⑨⑩ | D.⑤⑨ |
已知A、B、C、D、E是短周期中原子序数依次增大的5种元素,其中A与C可形成化学式为A2C,A2C2的液态共价化合物,A、D同主族,D的最高价氧化物对应水化物呈强碱性,B与E可形成直线型分子且每个原子最外层都满足8电子稳定结构,则下列说法正确的是()
A.工业上制取单质D是采用电解D的熔融氧化物
B.原子半径:D>E>B>C>A
C.D与E形成的化合物溶于水呈弱酸性
D.A与C形成的化合物与C、D形成的化合物,化学键类型相同
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法不正确的是()
| A.洗气瓶中产生的沉淀是碳酸钡 |
| B.在Z导管出来的气体中有二氧化碳 |
| C.洗气瓶中产生的沉淀是硫酸钡 |
| D.在Z导管口有红棕色气体出现 |