在一定条件下,可逆反应达到化学平衡时,下列说法中正确的是
| A.单位时间内反应物减少的分子数等于生成物增加的分子数 |
| B.反应物的浓度一定等于生成物的浓度 |
| C.混合物中各组分的质量分数是一定的 |
| D.反应物和生成物的浓度比一定等于化学方程式的系数比 |
在一定温度下,容器内某一反应中M、N的物质的量浓度随反应时间变化的曲线如图。则下列表述中正确的是( )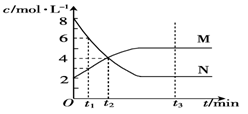
| A.该反应的化学方程式为2N ⇌ M |
| B.t1时,M的浓度是N浓度的2倍 |
| C.t3时,正反应速率大于逆反应速率 |
| D.t2时,正、逆反应速率相等,化学反应达到了平衡 |
在Al与稀H2SO4的反应中,已知10 s末H2SO4的浓度减少了0.6 mol·L-1,若不考虑反应过程中溶液体积的变化,则10 s内生成Al2 (SO4)3的平均反应速率为( )
| A.0.02 mol·L-1·s-1 | B.0.04 mol·L-1·s-1 | C.0.06 mol·L-1·s-1 | D.0.18 mol·L-1·s-1 |
化学反应N2+3H2=2NH3的能量变化如图所示,该反应的热化学方程式是( )
| A.N2(g)+3H2(g)=2NH3(1);△H=2(a-b-c)kJ·mol-1 |
| B.N2(g)+3H2(g)=2NH3(g);△H=2(b-a)kJ·mol-1 |
C. N2(g)+ N2(g)+ H2(g)=NH3(1);△H=(h+c-a)kJ·mol-1 H2(g)=NH3(1);△H=(h+c-a)kJ·mol-1 |
D. N2(g)+ N2(g)+ H2(g)=NH3(g);△H=(a+b)kJ·mol-1 H2(g)=NH3(g);△H=(a+b)kJ·mol-1 |
已知破坏1 mol H—H键、Cl—Cl键、H—Cl键分别需要吸收436 kJ、243 kJ、432 kJ能量,则由H2与Cl2生成1 mol HCl总的过程需要( )
| A.放热185 kJ | B.吸热185 kJ | C.放热92.5 kJ | D.吸热92.5 kJ |
用铁片与稀硫酸反应制取氢气时,下列措施不能使反应速率加快的是( )
| A.加热 | B.用98%的浓硫酸代替稀硫酸 |
| C.滴加少量硫酸铜溶液 | D.若用铁片改用铁粉 |