pH=12的氢氧化钠溶液稀释100倍后,pH=
(1)将饱和的FeCl3溶液逐滴加入到沸水中,溶液的颜色会不断加深,可得到一种红褐色透明液体。写出该过程的离子方程式
在上述溶液中逐滴加入稀硫酸溶液,发生的现象是
反应的离子方程式
(2)有Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种粒子,分别属于同一氧化还原反应中的反应物和生成物,则该反应的离子方程式是
其中还原剂与氧化剂的物质的量之比为。
SCN—离子与Cl—、Br—、I—离子性质相似,都能与AgNO3溶液反应生成沉淀,且该反应比SCN—与Fe3+的反应更易发生。利用该性质,可测定NaCl和NaBr混合物的组成。现称取混合物样品0.529 g溶于水后,加入过量的0.3000 mol·L-1的AgNO3溶液40.00 mL,再加入少量含Fe3+的溶液作指示剂,然后用0.2000 mol·L-1 NH4SCN溶液去滴定过量的Ag+,当滴到溶液恰好呈红色时,即达到终点,此时共用去NH4SCN溶液30.00 mL。试回答下列问题:
⑴所用的指示剂最好选用(填序号);
| A.Fe2(SO4)3 | B.Fe(NO3)3 | C.FeCl3 | D.FeBr3 |
⑵NH4SCN与Fe3+反应的离子方程式为:。
⑶计算混合物样品中NaCl和NaBr的物质的量之比。
第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需要的能量。下表是部分元素原子的第一电离能I1:(单位)
| H |
He |
||||||
| 1.3120 |
0.3723 |
||||||
| Li |
Be |
B |
C |
N |
O |
F |
Ne |
| 0.5203 |
0.8995 |
0.8001 |
1.0864 |
1.4023 |
1.3140 |
1.6810 |
2.0807 |
| Na |
Mg |
Al |
Si |
P |
S |
Cl |
Ar |
| 0.4958 |
0.7377 |
0.5776 |
0.7865 |
1.0118 |
0.9996 |
1.2511 |
1.5205 |
| K |
Ca |
Ga |
Ge |
As |
Se |
Br |
Kr |
| 0.4189 |
0.5898 |
0.5788 |
0.9440 |
0.9409 |
1.1399 |
1.3507 |
|
| Rb |
Sr |
In |
Sn |
Sb |
Te |
I |
Xe |
| 0.4030 |
0.5495 |
0.5583 |
0.7086 |
0.8316 |
0.8693 |
1.0084 |
1.1704 |
| Cs |
Ba |
Tl |
Pb |
Bi |
Po |
At |
回答下列问题:
(1)从表中数据可知,同一主族元素原子的第一电离能I1变化规律是 。说明同一主族元素 能力从上到下逐渐增强。
(2)从表中数据预测Ge元素第一电离能I1的最小范围。
(3)SiC是原子晶体,其结构类似金刚石,为C、Si两原子依次相同排列的正四面体空间网状结构。如图为两个中心重合,各面分别平行的两个正方体,其中心为Si原子,试在小正方体的顶点画出与Si最近的C(用 表示)的位置,在大正方体的棱、顶、面等处画出相应Si(用
表示)的位置,在大正方体的棱、顶、面等处画出相应Si(用 表示)的位置。
表示)的位置。
500℃时,将SO2和O2置于一容积固定为2 L的密闭容器中发生反应。反应过
程中SO2、O2和SO3物质的量变化如图所示,请回答下列问题:(1)反应10 min至15 min,
O2的平均反应速率为mol·(L·min)-1,比反应开始时前10 min速率 ,可能的原
因是 。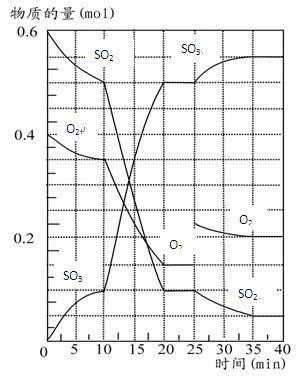
(2)从曲线变化可以看出,反应进行至25min时,采取了 使得平衡向
方向移动,达到新平衡后SO2的体积分数比原平衡小。
已知Ca(OH)2与Cl2反应的氧化产物与温度有关,在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应)。生成物中含有Cl—、ClO—、ClO3—三种含氯元素的离子,其中ClO—、ClO3—两种离子的物质的量(n)与反应时间(t)的曲线如图所示。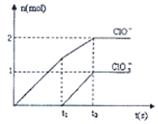
(1)t1前,氧化产物是________(填化学式)。
(2)t2时,Ca(OH)2与Cl2发生反应的总的离子方程式为:。
(3)该石灰乳中含有Ca(OH)2的物质的量是mol。
(4)NaClO2较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,其爆炸后的产物可能是。
| A.NaCl、Cl2 | B.NaCl、NaClO | C.NaClO3、NaClO4 | D.NaCl、NaClO3 |