化肥在农业生产中占有重要位置。国内外农学专家普遍认为,在其他生产因素不变的情况下,农作物施用化肥可增产40%-60%。合成氨工业可以提供大量的氮肥,是满足人类对粮食增长需求的非常重要的化学工业。
(1)在工业合成氨的反应中,由于该反应在常温常压下,慢得几乎不能觉察,要实现工业化非常困难,许多化学家为此进行了不懈的努力。他们先从温度和压强着手,温度升高对提高化学反应速率 (填有利、不利或无关),增加压强对提高化学反应速率 (填有利、不利或无关),科学家们虽然选择了合适的温度和压强,但效果不佳,仍无法投入工业化生产。德国化学家哈伯(Fritz Haber,1868-1934)通过努力,在使用合适催化剂的情况下终于解决了这个问题,实现了合成氨的工业化生产。你认为该反应能工业化生产的关键是
(2)合成氨是重要的人工固氮方法,除人工固氮外,还有自然固氮,闪电固氮就是自然固氮的一种方式,课堂上可用高压发生器模拟这一过程,装置如图所示: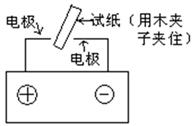
实验开始后,可以看到湿润的蓝色石蕊试纸变红色,请解释原因(用反应的化学方程式表示)
(12分)如图所示,组成一种原电池。试回答下列问题(灯泡功率合适):
(1)电解质溶液为稀H2SO4时,灯泡(填“亮”或“不亮”)。若灯泡亮,则Mg为原电池的极;若灯泡不亮,其理由为。
(2)电解质溶液为NaOH溶液时,灯泡(填“亮”或“不亮”)。若灯泡亮,则Al做原电池的极。若灯泡不亮,其理由为。
(3) 铝的阳极氧化,是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜,该氧化膜不溶于稀硫酸。某化学研究小组在实验室中按下列步骤模拟该生产过程。
按图取两片质量相当的铝片组装好仪器,接通开关K,通电约25 min。在阳极生成氧化铝,阴极产生气体。写出该过程中的阳极反应式:______________________________。
如果此时取出两极,用蒸馏水洗净,晾干后称重发现两个电极质量差为0.8克,计算阴极产物在标准状态下的体积并写出计算过程。
. 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K=,升高温度,K值(填“增大”、“减小”或“不变”)。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
| A.氢气的浓度减少 | B.正反应速率加快,逆反应速率也加快 |
| C.甲醇的物质的量增加 | D.重新平衡时n(H2)/n(CH3OH)增大 |
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:(用化学方程式表示)。
(9分)在一定温度下,向一个容积不变的容器中加入3 mol SO2和2 mol O2及固体催化剂,发生反应:2SO2(g)+O2(g)=2SO3(g)ΔH=-196.6 kJ/mol,平衡时容器内气体压强为起始时的90%。
(1)加入3mol SO2和3mol O2发生反应,达到平衡时,SO2的转化率为_____。
(2)保持温度不变,在相同的容器中,将起始物质的物质的量改为a mol SO2、b mol O2、c mol SO3(g)(c>0),欲使平衡时SO3的体积分数为2/9,O2的体积分数为3/9,则:
①达到平衡时,(1)与(2)放出的热量________(填序号)。
| A.相等 | B.前者小于后者 | C.前者大于后者 | D.无法确定 |
②a.b.c必需满足的关系是(一个用a.c表示,另一个用b.c表示):___。
(13分)在100℃时,将0.100 mol 的四氧化二氮气体充入 1 L 恒容真空的密闭容器中,隔一段时间对该容器内的物质浓度进行分析得到下表数据:
| 时间(s) |
0 |
20 |
40 |
60 |
80 |
| c(N2O4)(mol/L) |
0.100 |
c1 |
0.050 |
c3 |
c4 |
| c(NO2)(mol/L) |
0.000 |
0.060 |
c2 |
0.120 |
0.120 |
(1)该反应的平衡常数表达式为______________________;
从表中分析:c1________c2;c3________c4(填“>”、“<”或“=”)。
(2)在下图中画出并标明此反应中c(N2O4)和c(NO2)的浓度随时间变化的曲线。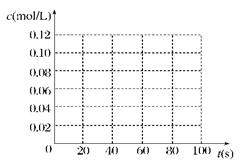
(3)在上述条件下,从反应开始直至达到化学平衡时,四氧化二氮的平均反应速率为__mol/(L·s)。
(4)反应达到平衡后,下列条件的改变可使NO2气体的浓度增大的是
A.增大容器的容积 B.再充入一定量的N2O4
C.分离出一定量的NO2 D.再充入一定量的He
(12分)(1)氢能源是21世纪极具有发展前景的新能源之一,它既是绿色能源,又可循环使用。请在下图的每个空格中填上循环过程中反应物和生成物的分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在):
①_____,②_____。从能量转换的角度看,过程Ⅱ应是____能转化为_____能。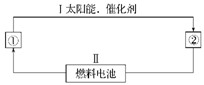
(2)图中的燃料电池也可以用A和氧气为原料。已知A分子是由碳和氢两元素的原子构成,并且8.00 g A中含有3.01×1023个分子。实验测得在298 K时,1 mol该气体完全燃烧生成液态水和二氧化碳,放出890 kJ的热量。
①写出该气体的化学式:______。
②写出1 mol该气体燃烧时的热化学反应方程式:_____________。
③已知1 mol液态的水变成气态水时需要吸收44 kJ的热量,则1 mol该气体完全燃烧生成气态水和二氧化碳时放出的热量为________kJ。
④若该燃料电池中的电解质溶液为氢氧化钾溶液,则:电池正极反应为______________。