金刚石、具有优良的耐磨、耐腐蚀特性,应用广泛.
(1)碳与短周期元素的单质化合仅能生成两种常见气态化合物,其中一种化合物为非极性分子.碳元素在周期表中的位置是,是,的电子式为.
(2)一定条件下,还原可制备金刚石,反应结束冷却至室温后,回收其中的的实验操作名称为,除去粗产品中少量钠的试剂为.
(3)碳还原制,其粗产品中杂质为和.现将20.0粗产品加入到过量的溶液中充分反应,收集到0.1氢气,过滤得固体11.4,滤液稀释到1.生成氢气的离子方程式为,硅酸盐的物质的量浓度为.
(4)下列叙述正确的有(填序号).
①还原的反应、与的反应均是置换反应
②水晶、干冰熔化时克服粒子间作用力的类型相同
③溶液与的反应可用于推断与的非金属性强弱
④钠、锂分别在空气中燃烧,生成的氧化物中阴阳离子数目比均为1:2.
下列反应曾用于检测司机是否酒后驾驶:
(1)
基态核外电子排布式为;配合物
中,与
形成配位键的原子是(填元素符号)。
(2)
中
原子轨道杂化类型为;1
分子中含有δ键的数目为。
(3)与
互为等电子体的一种阳离子为(填化学式);
与
可以任意比例互溶,除因为它们都是极性分子外,还因为。
烟气(主要污染物
、
)经
预处理后用
水悬浮液吸收,可减少烟气中
、
的含量。
氧化烟气中
、
的主要反应的热化学方程式为:
(1)反应
的
=
。
(2)室温下,固定进入反应器的
、
的物质的量,改变加入
的物质的量,反应一段时间后体系中
、
和
随反应前
的变化见右图。
①当
>1时,反应后
的物质的量减少,其原因是。
②增加
,
氧化
的反应几乎不受影响,其可能原因是。
(3)当用
水悬浮液吸收经
预处理的烟气时,清液(
约为 8)中
将
转化为
,其离子方程式为:。
(4)
水悬浮液中加入
溶液,达到平衡后溶液中
=[用
、
和
表示];
水悬浮液中加入
溶液能提高
的吸收速率,其主要原因是。
软锰矿(主要成分 ,杂质金属元素 、 、 等)的水悬浊液与烟气中 反应可制备 ,反应的化学方程式为:
(1)质量为17.40
纯净
最多能氧化
(标准状况)
。
(2)已知:
=1×10-33,
=3×10-39,
=7.1时
开始沉淀。室温下,除去
溶液中的
、
(使其浓度小于1×10-6
),需调节溶液
范围为。
(3)右图可以看出,从
和
混合溶液中结晶
晶体,需控制结晶温度范围为。
(4)准确称取0.1710
样品置于锥形瓶中,加入适量
和
溶液,加热使
全部氧化成
,用
=0.0500
的标准溶液滴定至终点(滴定过程中
被还原为
),消耗
溶液20.00
。计算
样品的纯度(请给出计算过程)
化合物
是一种抗心肌缺血药物的中间体,可以通过以下方法合成:
(1)化合物
中的含氧官能团为和(填官能团的名称)。
(2)化合物
的结构简式为;由
的反应类型是:。
(3)写出同时满足下列条件的E的一种同分异构体的结构简式。
Ⅰ.分子含有2个苯环Ⅱ.分子中含有3种不同化学环境的氢
(4)已知: ,请写出以
,请写出以 为原料制备化合物X(结构简式见图
为原料制备化合物X(结构简式见图 )的合成路线流程图(无机试剂可任选)。合成路线流程图示例如下:
)的合成路线流程图(无机试剂可任选)。合成路线流程图示例如下:
以磷石膏(只要成分
,杂质
、
等)为原料可制备轻质
。

(1)匀速向浆料中通入
,浆料清液的
和
随时间变化见由下图。清液
时
转化的离子方程式;能提高其转化速率的措施有(填序号) 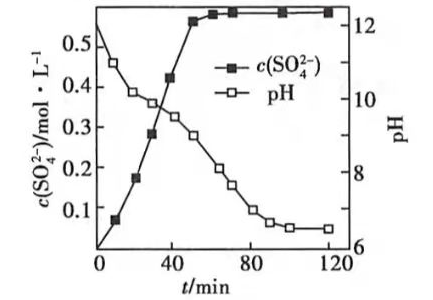
| A. | 搅拌浆料 | B. | 加热浆料至100℃ |
| C. | 增大氨水浓度 | D. | 减小 通入速率 |
(2)当清液pH接近6.5时,过滤并洗涤固体。滤液中物质的量浓度最大的两种阴离子为和(填化学式);检验洗涤是否完全的方法是。
(3)在敞口容器中,用
溶液浸取高温煅烧的固体,随着浸取液温度上升,溶液中
增大的原因。