燃煤锅炉将排放大量SO2,污染大气造成公害,常采用两种方法消除燃煤SO2的污染。
(1)使排放的烟气通过氨水洗涤,化学方程式是
(2)在煤中加适量石灰,使SO2与石灰反应,化学方程式为 ,
该生成物仍可被氧化而成稳定的石膏,化学方程式为 。
过渡金属催化的新型碳-碳偶联反应是近年来有机合成的研究热点之一,如反应①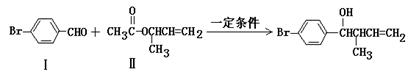
化合物Ⅱ可由化合物Ⅲ合成: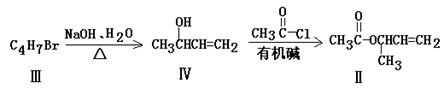
(1)化合物I的分子式为______________。
(2)化合物Ⅱ与Br2加成的产物的结构简式为____________。
(3)化合物Ⅲ的结构简式为______________。
(4)在浓硫酸存在和加热条件下,化合物Ⅳ易发生消去反应生成不含甲基的产物,该反应方程式为______________(注明反应条件)。因此,在碱性条件下,由Ⅳ与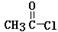 反应合成Ⅱ,其反应类型为___________。
反应合成Ⅱ,其反应类型为___________。
(5)Ⅳ的一种同分异构体V能发生银镜反应。V与Ⅱ也可发生类似反应①的反应,生成化合物Ⅵ,Ⅵ的结构简式为___________(写出其中一种)。
(5分) 在某些酶的催化下,人体内葡萄糖的代谢有如下过程: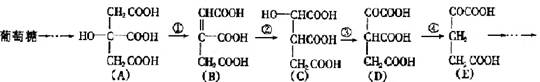
请填空:
(1)过程①是反应,过程②是反应,过程③是反应(填写反应类型的名称)。
(2)过程④的另一种生成物是(填写化学式)。
(3)上述物质中和互为同分异构体(填写字母代号)。
(3分)近来研究认为松果体分泌物——“退黑素”(英文名称melatonin,简称MLT)与人的寿命长短有关、有人把“退黑素”和克隆技术并称为“二十世纪生命科学的两大发现”。退黑素的化学结构简式为: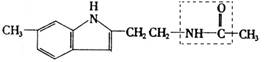
(1)退黑素的分子式为
(2)退黑素结构简式中,虚线框内的结构名称为,它在稀硫酸中受热后生成的具有酸性的物质的最简式为。
(8分)已知乳酸的结构简式为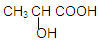 ,试类比乙醇中—OH和乙酸中—COOH的性质,回答下列问题:
,试类比乙醇中—OH和乙酸中—COOH的性质,回答下列问题:
(1)写出乳酸发生下列反应的化学方程式
①与足量的金属钠反应________________________________________
②与少量的碳酸钠反应 _______________________________________
(2)由乳酸的组成和结构推断还可能发生的哪些类型的反应,写出两种反应类型:。
有A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20;只有C、E是金属元素;A和E元素原子的最外层电子都只有一个;B和D 元素原子的最外层电子数相同,且B元素原子L层电子数是K层电子数的3倍;C元素原子的最外层电子数是D元素原子最外层电子数的一半。由此可知:
(1)C在元素周期表中的位置是______________________。
(2)D元素最高价氧化物对应水化物的分子式为,形成E元素最高价氧化物对应水化物的化学键类型____________________。
(3)D与E形成的化合物属于(填“离子化合物”或“共价化合物”)。
(4)写出C与NaOH溶液反应的离子方程式:________________________.