进行下列反应后,所得溶液中一定只含一种溶质的是 ( )
| A.向MgSO4.H2SO4的混合溶液中加入过量的氢氢化钡溶液 |
B.F e3O4溶于适量的稀盐酸中 e3O4溶于适量的稀盐酸中 |
| C.向稀盐酸中滴入少量的NaAlO2溶液 |
D.NaO H溶液与CH3COOH溶液反应后所得到的PH>7的溶液 H溶液与CH3COOH溶液反应后所得到的PH>7的溶液 |
化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol 化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如下图所示,现提供以下化学键的键能(KJ·mol–1)P–P:198 P–O:360 O=O:498 则反应P4(白磷,s)+ 3O2(g)==P4O6(s)的反应热△H为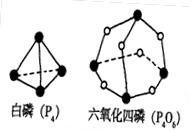
| A.+1638KJ·mol–1 | B.–1638KJ·mol–1 |
| C.+126KJ·mol–1 | D.–126KJ·mol–1 |
在密闭容器中,反应X2(g)+Y2(g)  2XY(g) ΔH <0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是
2XY(g) ΔH <0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是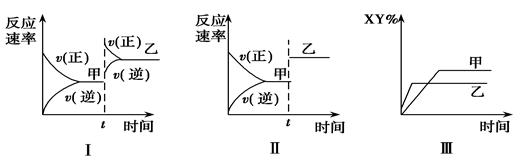
| A.图Ⅰ是增大压强的变化情况 |
| B.图Ⅱ一定是加入催化剂的变化情况 |
| C.图Ⅲ是增大压强或升高温度的变化情况 |
| D.图Ⅲ是升高温度的变化情况 |
在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g) 
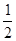 N2(g)+CO2(g);ΔH=-373.2 kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
N2(g)+CO2(g);ΔH=-373.2 kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
| A.加催化剂同时升高温度 | B.加催化剂同时增大压强 |
| C.升高温度同时充入N2 | D.降低温度同时增大压强 |
在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应X(g)+Y(g)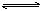 2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
下列说法正确的是
| t/min |
2 |
4 |
7 |
9 |
| n(Y)/mol |
0.12 |
0.11 |
0.10 |
0.10 |
A.反应前2 min的平均速率v(Z)= 2.0×10-3 mol/(L·min)
B.其他条件不变,降低温度,反应达到新平衡前v逆>v正
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大
下列可逆反应达平衡状态后,降温可以使混和气体平均相对分子质量减小的是
A.H2(气)+Br2(气)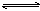 2HBr(气) (正反应为放热反应) 2HBr(气) (正反应为放热反应) |
B.N2(气)+3H2(气)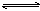 2NH3(气) (正反应为放热反应) 2NH3(气) (正反应为放热反应) |
C.2SO3(气)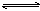 2SO2(气)+O2(气) (正反应为吸热反应) 2SO2(气)+O2(气) (正反应为吸热反应) |
D.4NH3(气)+5O2(气)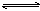 4NO(气)+6H2O(气) (正反应为放热反应) 4NO(气)+6H2O(气) (正反应为放热反应) |