下列各组溶液,只要用试管和胶头滴管,不用任何试剂难以鉴别的是 ( )
①偏铝酸钠和盐酸 ②氢氧化钡和硫酸氢钠溶液
③硝酸银和氨水 ④碳酸氢钠和盐酸
| A.①③ | B.②④ | C.①② | D.③④ |
用下列实验装置进行相应实验,能达到实验目的的是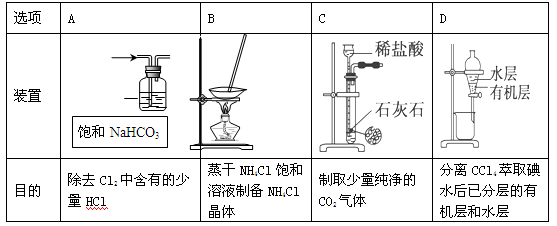
能正确表示下列离子方程式的是
| A.用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2=2NH4++SO32—+H2O |
B.铜与浓硫酸混合加热:Cu+2H2SO4(浓) Cu2++SO42—+2H2O+SO2↑ Cu2++SO42—+2H2O+SO2↑ |
| C.过量的浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑ |
| D.明矾溶液中滴加氢氧化钡溶液使沉淀质量最大:Al3++2SO SO42—+2Ba2++3OH-= 2BaSO4↓+Al(OH)3↓ |
M、X、Y、Z、W为五种短周期元素,原子序数依次递增,X、Y、Z是同周期元素,且最外层电子数之和为15,X与Z可形成气体分子XZ2,Y与M形成的气态化合物密度在相同状况下是氢气的8.5倍,W的质子数是M、X、Y、Z四种元素质子数之和的一半。下列说法正确的是
| A.原子半径:M>Z>Y>X>W |
| B.XZ2、X2M2、W2Z2均为直线型的共价化合物 |
| C.由X、Y、Z、M四种元素形成的化合物不能含有离子键 |
| D.由X元素形成的某种单质能导电,可以做电极 |
设NA为阿伏加德罗常数的数值.下列说法不正确的是
| A.常温常压下,18g14CH4所含中子数目为8NA |
| B.常温常压下,分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA |
| C.含0.3molCl-的FeCl3水解制成胶体,所得胶体粒子数为0.1NA |
| D.60gSiO2晶体中含有硅氧键的数目为4NA |
下列有关物质分类或归纳不正确的是
①电解质:明矾、冰醋酸、氯化银、纯碱②化合物:BaCl2、Ca(OH)2、HNO3、HT
③混合物:盐酸、漂白粉、水玻璃、水银④同素异形体:金刚石、石墨、C60、C70
| A.①② | B.②③ | C.③④ | D.②④ |