在容积为VK的密闭容器中发生2NO2 2NO+O2的反应。反应过程中NO2的物质的量 随时间变化的状况如图所示。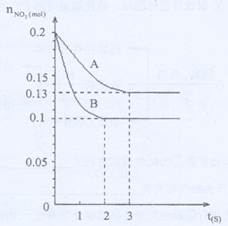
(1)若曲线A和B表示的是该反应在某不同条件下的反应状况,则该不同条件是( )
A.有、无催化剂B.温度不同C.压强不同D.V值不同
(2)写出该反应的化学平衡常数K的表达式 ,并比较K800℃ K850℃(填>、<或=)。
(3)在图上作出在A条件下NO的变化曲线,并求算在B条件下从反应开始至达到平衡,氧气的反应速率VO2= 。
(4)不能说明该反应已达到平衡状态的是 ( )
A.V正(NO2)=V逆(NO) B.C(NO2)=C(NO)
C.气体的平均摩尔质量不变 D.气体的密度保持不变
下表中的事实与推论不符的是()
| 序号 |
事实 |
推论 |
| A |
与冷水反应,Na比Mg剧烈 |
金属性:Na>Mg |
| B |
Ca(OH)2的碱性强于Mg(OH)2 |
金属性:Ca>Mg |
| C |
SO2与NaHCO3溶液反应生成CO2 |
非金属性:S>C |
| D |
HCl热稳定性比H2S强 |
非金属性:Cl>S |
YBa2Cu8Ox(Y为元素钇)是一种重要超导材料,下列关于 Y的说法错误的是()
Y的说法错误的是()
| A.属于金属元素 |
| B.质子数与中子数之差为50 |
| C.原子的核外电子数是39 |
D. Y和 Y和 Y 是两种不同的核素 Y 是两种不同的核素 |
在恒容条件下,能使NO2(g)+CO(g)  CO2(g)+NO(g)正反应速率增大且活化分子的百分数也增加的措施是
CO2(g)+NO(g)正反应速率增大且活化分子的百分数也增加的措施是
| A.增大NO2或CO的浓度 | B.减小CO2或NO的浓度 |
| C.通入Ne使气体的压强增大 | D.升高反应的温度 |
四种短周期元素在元素周期表中的相对位置如图所示,其中丙元素最外层电子数是其电子层数的2倍。下列叙述正确的是()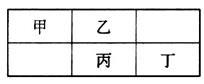
| A.四种元素的单质中,丙单质的熔、沸点最高 |
| B.丁元素氧化物对应水化物的酸性一定强于丙 |
| C.乙元素形成的单核阴离子还原性强于丙 |
| D.丁元素单质在化学反应中只表现氧化性 |
可逆反应 2NO2(g) 2NO(g)+O2(g)在体积不变密闭容器中反应,达到平衡状态的标志是:
2NO(g)+O2(g)在体积不变密闭容器中反应,达到平衡状态的标志是:
①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2的同时,生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
| A.①④⑥ | B.②③⑤ | C.①③④ | D.①②③④⑤⑥ |