反应4A(s)+3B(g)===2C(g)+D(g),经2min ,B的浓度减少了0.6mol/L。对此化学反应速率的正确表示是
,B的浓度减少了0.6mol/L。对此化学反应速率的正确表示是
A.用A表示的反应速率是0.4mol/(L∙min)
B.分别用B、C、D表示反应的速率,其比值是3:2:1
C.在2min末的反应速率,用B表示是0.3 mol/(L∙min)
D.在这2min内B和C 物质浓度都逐渐减少
物质浓度都逐渐减少
用过量的H2SO4、NaOH、NH3·H2O、NaCl等溶液,按如图所示步骤分开五种离子,则溶液①、②、③、④是 ( )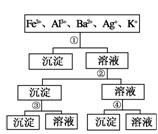
| A.①NaCl ②NaOH ③NH3·H2O ④H2SO4 |
| B.①H2SO4 ②NaOH ③NH3·H2O ④NaCl |
| C.①H2SO4 ②NH3·H2O ③NaOH ④NaCl |
| D.①NaCl ②NH3·H2O ③NaOH ④H2SO4 |
研究发现,空气中少量的NO2能参与硫酸型酸雨的形成,反应过程如下:
①SO2+NO2→SO3+NO②SO3+H2O→H2SO4③2NO+O2→2NO2
NO2在上述过程中的作用,与H2SO4在下列变化中的作用相似的是()
| A.加入少量H2SO4使淀粉水解 | B.碳酸钠与硫酸反应 |
| C.向铜和双氧水的混合物中加入硫酸 | D.潮湿的氯气通过盛有浓H2SO4的洗气瓶 |
下列反应的离子方程式正确的是()
| A.将标准状况下112 mL氯气通入10mL 1 mol/L的溴化亚铁溶液中: 2Fe2++4Br-+3Cl2==2Fe3++2Br2+6Cl- |
| B.滴有稀硫酸的淀粉碘化钾溶液在空气中变蓝:2I-+O2+4H+="==" I2+2H2O |
| C.SO2溶液使酸性KMnO4溶液褪色:5SO2+ 2MnO4-+2H2O ="==" 5SO42- + 2Mn2+ + 4 H+ |
D.向次氯酸钙溶液中通入SO2: Ca2++ Ca2++ 2ClO-+ SO2+H2O ="==" CaSO3↓+2HClO 2ClO-+ SO2+H2O ="==" CaSO3↓+2HClO |
A、B、C、D四种物质间能够实现下列转化,不符合转化关系的A物质是()
A.硅B.硫C.钠D.氯气
同位素示踪法可用于反应机理的研究,下列反应或转化中同位素示踪表示正确的是( )
| A.2Na218O2 + 2H2O ="=" 4Nal8OH + O2↑ |
B.NH4Cl + 2H2O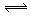 NH3·2H2O + HCl NH3·2H2O + HCl |
| C.2KMnO4 + 5H218O2 + 3H2SO4 ="=" K2SO4 + 2MnSO4 + 518O2↑+ 8H2O |
| D.K37ClO3 + 6HCl ="=" K37Cl + 3Cl2↑+ 3H2O |