下列反应的离子方程式正确的是( )
| A.将标准状况下112 mL氯气通入10mL 1 mol/L的溴化亚铁溶液中: 2Fe2++4Br-+3Cl2==2Fe3++2Br2+6Cl- |
| B.滴有稀硫酸的淀粉碘化钾溶液在空气中变蓝:2I-+O2+4H+="==" I2+2H2O |
| C.SO2溶液使酸性KMnO4溶液褪色:5SO2+ 2MnO4-+2H2O ="==" 5SO42- + 2Mn2+ + 4 H+ |
D.向次氯酸钙溶液中通入SO2: Ca2++ Ca2++ 2ClO-+ SO2+H2O ="==" CaSO3↓+2HClO 2ClO-+ SO2+H2O ="==" CaSO3↓+2HClO |
下列有关物质的性质与应用不相对应的是
| A.氢氟酸具有弱酸性,可用于雕刻玻璃 |
| B.MgO、Al2O3熔点高,可用于制作耐火材料 |
| C.ClO2具有强氧化性,可用于自来水的杀菌消毒 |
| D.油脂在碱性条件下易水解,可用于制作肥皂 |
实验室可用NaNO2+NH4Cl =NaCl+N2↑+2H2O制备N2,下列说法正确的是
| A.NaNO2发生氧化反应 |
| B.NH4Cl中的氮元素被还原 |
| C.N2既是氧化产物,又是还原产物 |
| D.每生成1mol N2转移电子的物质的量为6mol |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.1.0 mol·L-1 KNO3溶液:H+、Fe2+、SCN-、SO42- |
| B.c(H+)/ c (OH—)=10-10的溶液:K+、Ba2+、NO3-、Cl- |
| C.pH=0的溶液:Al3+、Ag(NH3)2+、Cl-、SO42- |
| D.c(ClO-)=1.0 mol·L-1的溶液:Na+、SO32-、S2-、SO42- |
下列表述正确的是
| A.中子数为10的氧原子:18 10O |
B.Na2S的电子式: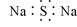 |
| C.聚氯乙烯的结构简式:CH2CHCl |
| D.Mg5(Si4O10)2(OH)2·4H2O的氧化物形式:5MgO·8SiO2·5H2O |
化学与材料、生活和环境密切相关。下列有关说法中错误的是
| A.新型材料聚酯纤维、光导纤维都属于有机高分子 |
| B.医药中常用酒精来消毒,是因为酒精能够使细菌蛋白发生变性 |
| C.大力实施矿物燃料脱硫脱硝技术以减少硫、氮氧化物排放 |
| D.煤炭经气化、液化和干馏等过程,可获得清洁能源和重要的化工原料 |