右图是恒温下某化学反应的反应速率随反应时间变化的示意图。下列叙述与示意图不相符合的是()
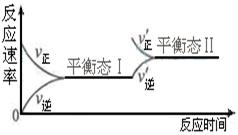
| A. | 反应达平衡时,正反应速率和逆反应速率相等 |
| B. | 该反应达到平衡态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡态Ⅱ |
| C. | 该反应达到平衡态后,减小反应物浓度,平衡发生移动,达到平衡态Ⅱ |
| D. | 同一种反应物在平衡态Ⅰ和平衡Ⅱ时浓度不相等 |
常温时,Ksp[Mg(OH)2] = 1.1×10-11,Ksp(AgCl) = 1.8×10-10,
Ksp(Ag2CrO4) = 1.9×10-12Ksp(CH3COOAg) = 2.3×10-3,下列叙述不正确的是
| A.浓度均为0.2 mol·L-1的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀 |
| B.将0.001 mol·L-1的AgNO3溶液滴入0.001 mol·L-1的KCl和0.001 mol·L-1的K2CrO4溶液中,先产生Ag2CrO4沉淀 |
| C.c(Mg2+)为0.11 mol·L-1的溶液中要产生Mg(OH)2沉淀,溶液的pH要控制在9以上 |
D.在 其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变 其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变 |
下列有关实验的操作、原理和现象,正确的是
| A.减压过滤是为了加快过滤速度,得到较大颗粒的晶体 |
| B.硫酸亚铁铵晶体过滤后用无水乙醇洗涤 |
| C.纸层析法分离铁离子和铜离子实验中,展开剂的成份为蒸馏水与丙酮 |
| D.欲分离硝酸钾和氯化钠的混合物(物质的量比为1:1),先将样品溶解,然后加热至表面出现晶膜后冷却,过滤得硝酸钾晶体;将母液加热至大量晶体析出后,用余热蒸干,得氯化钠晶体 |
常温时,下列关于电解质溶液的叙述正确的是
| A.稀释pH= 10的氨水,溶液中所有离子的浓度均降低 |
| B.常温下物质的量浓度相等的①(NH4)2CO3、②NH4Al(SO4)2、③(NH4)2Fe(SO4)2三种溶液中c (NH4+):③>①>② |
| C.pH=11的NaOH和pH=11的氨水分别稀释100倍后的pH前者一定大于后者 |
D.分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的 量多 量多 |
在容积不变的密闭容器中有反应:X(g) + Y(g) 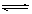 z(g),若Z(g)的物质的量浓度c(Z)
z(g),若Z(g)的物质的量浓度c(Z) 与温度T的关系如右图所示。
与温度T的关系如右图所示。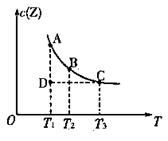
则下列说法不正确的是
A.A点与B点相比,B点的c (X)大
B.A点与C点的化学反应速率:前者<后者
C.在反应进行到D点时,V正<V逆
D.A、B、C点都表示该反应达平衡状态
下列叙述正确的是
A.恒容密闭容器中进行的反应3A(g)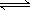 B(g)+C(g),在其它条件不变情况下, B(g)+C(g),在其它条件不变情况下,再充入一定量的A气体,A的转化率将增大 |
| B.对于可逆反应N2(g)+3H2(g)==2NH3(g),增大氮气浓度可增加活化分子百分数,从而使反应速率增加 |
| C.将AlCl3溶液和NaAl02溶液分别蒸干后灼烧,所得固体产物均为Al2O3 |
| D.反应NH3(g)+HCl(g)=NH4Cl(s) △H<0在任何条件下均能自发进行 |