(氮化硅()是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
++ +(1)配平上述反应的化学方程式(将化学计量数填在方框内);
+(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)该反应中的氧化剂是,其还原产物是;
(3)该反应的平衡常数表达式为=;
(4)若知上述反应为放热反应,则其反应热Δ零(填"大于""小于"或"等于");升高温度,其平衡常数值(填"增大""减小"或"不变");
(5)若使压强增大,则上述平衡向反应方向移动(填"正"或"逆");
(6)若已知生成速率为=18·()-1,
则消耗速率为=·()-1。
某有机物A(只含C、H、O三种元素)是一种重要化工生产的中间体。已知:
①A的蒸气密度是相同状况下氢气密度的83倍,分子中碳原子总数是氧原子总数的3倍。
②A属于芳香族化合物,其苯环上只有一个取代基,且取代基碳链上无支链;
③A可与NaHCO3溶液作用,产生无色气泡;
④A在一定条件下可与乙酸发生酯化反应;
⑤A存在如下转化关系:
试根据以上信息回答问题:
(1)A的分子式__________________;A中含氧官能团的名称__________________。
(2)D的结构简式为__________________。
(3)写出A→C和A→B的化学反应方程式(注明反应条件),并注明反应类型:
A→C:_______________________ _,反应类型:__________________;
_,反应类型:__________________;
A→B:________________________,反应类型:__________________。
(4)符合下列三个条件的A的同分异构体的数目共有__________________个。
①苯环上只有两个邻位取代基
②能与三氯化铁溶液发生显色反应
③一定条件下可以水解生成两种物质
写出其中任意一个同分异构体的结构简式______________________________。
有E、Q、T、X、Z五种前四周期元素,原子序数E<Q<T<X<Z。E、Q、T三种元素的基态原子具有相同的能级,且I1(E)<I1(T)<I1(Q),其中基态Q原子的2p轨道处于半充满状态,且QT2+与ET2互为等电子体。X为周期表前四周期中电负性最小的元素,Z的原子序数为28。
请回答下列问题(答题时如需表示具体元素,请用相应的元素符号):
⑴ 写出QT2+的电子式______、基态Z原子的核外电子排布式______。
⑵ Q的简单氢化物极易溶于T的简单氢化物,其主要原因有______等两种。
⑶ 化合物甲由T、X两元素组成,其晶胞如图1,甲的化学式为______。
⑷化合物乙的晶胞如图2,乙由E、Q两元素组成,硬度超过金刚石。
①乙的晶体类型为______。
②乙的晶体中E、Q两种元素原子的杂化方式均为______。
碘酸钾是一种白色结晶粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560℃开始分解。工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:I2+KClO3+H2O→KH(IO3)2+KCl+Cl2(未配平)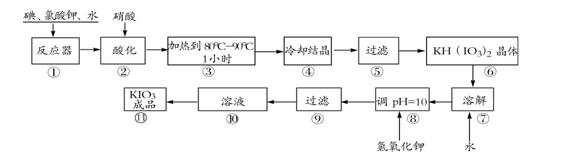
(1)在反应器中发生的反应I2+KClO3+H2O→KH(IO3)2+KCl+Cl2(未配平),生成两种还原产物所得电子数目相同,请写出已配平的该反应的化学方程式: _______________。
若有1 mol I2完全反应,则该反应中转移电子的数目为______(设NA表示阿伏加德罗常数)
(2)步骤②中,用硝酸而不用HI,其原因可能是________________________。
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为________。
(4)参照下表碘酸钾的溶解度,步骤11得到碘酸钾晶体,你建议的方法是__________。
| 温度/℃ |
0 |
10 |
20 |
40 |
60 |
80 |
| KIO3g/100g水 |
4.60 |
6.27 |
8.08 |
12.6 |
18.3 |
24.8 |
(5)KIO3可用电解的方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定温度和电流下电解KI溶液。总反应方程式为KI+3H2O=KIO3+3H2↑,则阳极的电极反应式为:___________________________。
能源问题是当前世界各国所面临的严重问题,同时全球气候变暖,生态环境问题日益突出,开发氢能、研制燃料电池、发展低碳经济是化学工作者的研究方向。
I.氢气通常用生产水煤气的方法制得。其中CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
△H<0。在850℃时,平衡常数K=1。
(1)若降低温度到750℃时,达到平衡时K1(填“大于”、“小于”或“等于”)
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0molCO、3molH2O、1.0molCO2
和x molH2,则:
①当x=5.0时,上述反应向(填“正反应”或“逆反应”)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是。
③在850℃时,若设x=5.0和x=6.0,其它物质的投料不变,当上述反应达到平衡后,
测得H2的体积分数分别为a%、b%,则ab(填“大于”、“小于”或“等于”)
II.已知4.6g液态乙醇完全燃烧生成二氧化碳和液态水放出热量136kJ·mol液态水转
化为气体水吸收44kJ的热量。
(3)请写出乙醇燃烧生成气态水的热化学方程式
。
(4)将0.1mol乙醇在足量氧气中燃烧,得到的气体全部通入到100mL3mol/LNaOH溶液中,忽略HCO-3的电离,则所得溶液中c(CO2-3)c(HCO-3)(填“大于”、“小于”或“等于”,)原因是(用文字叙述)。
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式 有;
有;
(2)硫酸铜溶液可以加快氢气生成速率的原因是
;
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中
CuSO4溶液起相似作用的是 ;
(4)要加快上述实验中气体产生的速率,还可采取的措施有
;
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体。
记录获得相同体积的气体所需时间。
 实验 实验混合溶液 |
A |
B |
C |
D |
E |
F |
| 4 mol·L-1 H2SO4/mL |
30 |
V1 |
V2 |
V3 |
V4 |
V5 |
| 饱和CuSO4溶液/mL |
0 |
0.5 |
2.5 |
5 |
V6 |
20 |
| H2O/mL |
V7 |
V8 |
V9 |
V10 |
10 |
0 |
①请完成此实验设计,其中:V1=,V6=,V9=;
②反应一段时间后,实验A的金属是呈色,实验E中的金属呈;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因。 .