某有机化合物()与另一有机化合物发生如下反应生成化合物():
+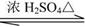 +
+
(1)是下列化合物之一,已知不能与溶液发生显色反应。则是(填标号字母)。
(2)的分子式是,可能的结构简式是:和。
(3)有多种同分异构体,其中一种同分异构体发生银镜反应后,其产物经酸化可得()。可发生如下反应:
F
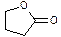 +该反应的类型是,的结构简式是。
+该反应的类型是,的结构简式是。
(4)若与具有相同的碳链,则的结构简式为:。
某化工厂甲、乙两车间排放的废水中,分别含有较多量的Na2CO3和有毒物质CuSO4,两车间排放的废气中含有较多的SO2等有害气体。环保部门建议选用生石灰、铁屑和水等廉价易得的原料,综合治理上述污染,并回收得到铜和亚硫酸钠等有用物质。写出实现上述要求的化学方程式。(可不填满)
________________________________________________________________________;
________________________________________________________________________;
________________________________________________________________________;
________________________________________________________________________。
硝酸是极其重要的化工原料,工业上将产生的NO2在密闭容器中用水多次反复循环吸收制备硝酸。
(1)工业上用水吸收NO2生产HNO3,生成的气体经多次氧化、吸收的循环操作充分转化为硝酸(假定上述过程无其他损失)。试写出上述反应的化学方程式:
______________________________________________________________。
(2)为了证明NO也可以与氧气和水共同反应生成HNO3,某学生设计了如图所示装置(有关夹持装置已略去)。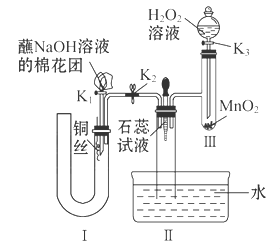
①检查装置气密性良好后,为观察到NO气体生成,打开K1,关闭K2,应从U形管的长管口注入稀硝酸至 后,迅速关闭K1,观察到U形管内的现象是____________________________________________________。
②装置Ⅲ中发生反应的化学方程式为_______________________________。
③蘸NaOH溶液的棉花团的作用是___________________________________。
④打开K2,至装置Ⅱ中长玻璃管中的气体呈无色后,打开K3,反应一段时间后,长玻璃管中并未充满液体。设计简单方法检验长玻璃管中的气体是否含NO__________________________________________________。
下列叙述正确的是______________。
①SO2、NO、NO2都是形成酸雨的因素,都能和水反应生成酸
②除去CO2中少量的SO2,将混合气体通过饱和Na2CO3溶液
③水晶的主要成分是SiO2
④SiO2与CO2都属于酸性氧化物,都不能与酸反应
⑤将CO2通入饱和Na2CO3溶液中有沉淀产生,继续通入CO2沉淀溶解
⑥某酸雨样本采集后放置一段时间,pH由4.68变为4.28,是因为水中溶解了较多的CO2
⑦CO2不能与CaCl2溶液反应,SO2也不能与CaCl2溶液反应
⑧实验室可用NaOH溶液处理NO2和SO2废气
⑨用稀双氧水清洗伤口可以杀菌消毒
⑩NO只能用排水集气法收集,不能用排空气法收集;而NO2只能用排空气法收集,不能用排水集气法
纯碱、烧碱等是重要的化工原料。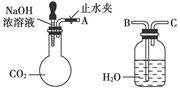
(1)利用上图所示装置可间接证明二氧化碳与烧碱溶液发生了反应。将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是,若其他操作不变,将A与C连接,可观察到的现象是。
(2)向NaOH溶液中通入一定量CO2,结晶后得到白色固体,该白色固体的组成可能是
| A.NaOH和Na2CO3; | |
| B.; | |
| C.; | D.。 |
(3)设计实验确定(2)中白色固体中存在A项中的阴离子:
| 实验操作 |
实验现象 |
结论 |
| (1)取少量白色固体于试管中,加足量水溶解,再加足量BaCl2溶液 |
||
| (2) |
用大试管收集一试管NO2气体,倒扣在盛水的水槽里,试管内产生的现象为;再往试管里通入适量氧气,试管内又产生的现象为。产生上述现象的原因是