考生注意:23题为分叉题,分A、B两题,考生可任选一题。若两题均做,一律按A题计分。A题适合使用二期课改新教材的考生解答,B题适合使用一期课改教材的考生解答。
(A)现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| T |
M层上有2对成对电子 |
| X |
最外层电子数是次外层电子数的2倍 |
| Y |
常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z |
元素最高正价是+7价 |
(1)元素T的原子最外层共有 种不同运动状态的电子。元素X的一种同位素可测定文物年代,这种同位素的符号是
(2)元素Y与氢元素形成一种离子YH4+,写出该微粒的电子式 (用元素符号表示)
(3)元素Z与元素T相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是
a.常温下Z的单质和T的单质状态不同 b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是 ,理由是
。
(B)现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| T |
单质能与水剧烈反应,所得溶液呈弱酸性 |
| X |
L层p电子数比s电子数多2个 |
| Y |
第三周期元素的简单离子中半径最小 |
| Z |
L层有三个未成对电子 |
(1)写出元素X的离子结构示意图 。
写出元素Z的气态氢化物的电子式 (用元素符号表示)
(2)写出Y元素最高价氧化物水化物的电离方程式
(3)元素T与氯元素相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是
a.常温下氯气的颜色比T单质的颜色深
b.T的单质通入氯化钠水溶液不能置换出氯气
c.氯与T形成的化合物中氯元素呈正价态
(4)探寻物质的性质差异性是学习的重要方法之—。T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是 ,理由 。
(1)铜是人类最早使用的金属之一,以下是冶炼铜的一个反应:
Cu2S+2Cu2O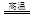 6Cu+SO2
6Cu+SO2
该反应中被氧化的元素是,若反应中转移1mol电子,得到Cumol。
(2)下列两种方法均可以制备CuSO4。
方法一:2Cu+O2 2CuO,CuO+H2SO4=CuSO4+H2O
2CuO,CuO+H2SO4=CuSO4+H2O
方法二:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
①假如某工厂欲生产CuSO4,请选择一种方法,并说明理由:
。
②有同学认为,生成等量的硫酸铜两种方法消耗的能量相同,因为反应都是铜转变为CuSO4,你认为上述说法(填“正确”或“不正确”),原因是
。
重铬酸钾(K2Cr2O7)为用途极广的铬化合物。铬铁矿的主要成分可表示为FeO•Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备K2Cr2O7晶体的过程
如下图所示:
已知:①K2Cr2O7有强氧化性
②NaFeO2遇水强烈水解
③Cr2O72-+ H2O  2CrO42- + 2H+
2CrO42- + 2H+
请回答:
(1)煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是 。
(2)滤液1的成分除NaOH、Na2CrO4外,还含有(填化学式) ;
生成滤渣1中红褐色物质的反应离子方程式是 。
(3)由滤液2转化为Na2Cr2O7溶液应加入的试剂是 。
(4)向Na2Cr2O7溶液中加入K2SO4固体,发生复分解反应而制得K2Cr2O7。生成K2Cr2O7晶体的过程是:加热浓缩、降温结晶、过滤、洗涤、干燥。试简述此法能够制得K2Cr2O7晶体的原因是:;
洗涤时应选用 (选填字母)。
| A.蒸馏水 | B.酒精 | C.稀硫酸 | D.饱和K2SO4溶液 |
(5 )工业上常用Fe2+处理酸性K2Cr2O7废水,先将Cr2O72— 转化为Cr3+,该反应的离子方程式为,再调节溶液的pH使金属离子生成沉淀而除去。
A、B、C、D均为中学化学中常见的物质,它们之间的转化关系如下图(部分产物已略去):
试回答:
(1)若D是具有氧化性的单质,则属于短周期的主族金属元素A为 (填元素符号)。
(2)若D是金属单质,D在潮湿的空气中易发生吸氧腐蚀,C溶液在保存时应加入酸和少量D防止其变质,若不加D则C溶液在空气中变质的离子方程式为 ;将D的氯化物的水溶液蒸干并灼烧产物是 。
(3)若A、B、C均为无机化合物,且均含地壳中含量最高的金属元素E,在溶液中A和C反应生成B。请写出B转化为C的所有可能的离子方程式 。
(4)将第(1)题推出的A单质与第(3)题E单质的混合物11.9g投入一定量的水中充分反应,A与E均没有剩余,共收集到标准状况下的气体vL。向所得溶液中逐滴加入浓度为2mol•L-1的H2SO4溶液,至100mL时白色沉淀达到最大量。则v= 。
A、B、C、D、E、F、G、H是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如下表:
| 元素 |
相关信息 |
| A |
原子核外有6种不同运动状态的电子 |
| C |
基态原子中s电子总数与p电子总数相等 |
| D |
原子半径在同周期元素中最大 |
| E |
基态原子最外层电子排布式为3s23p1 |
| F |
基态原子的最外层p轨道有两个电子的自旋方向与其它电子的自旋方向相反 |
| G |
基态原子核外有7个能级且能量最高的能级上有6个电子 |
| H |
是我国使用最早的合金中的最主要元素 |
请用化学用语填空:
(1)A元素位于元素周期表第 周期 族,B元素和C元素的第一电离能比较,较大的是 ,C元素和F元素的电负性比较,较小的是 。
(2)B元素与宇宙中含量最丰富的元素形成的最简单化合物的分子构型为 ,
B元素所形成的单质分子中σ键与π键数目之比为 。
(3)G元素的低价阳离子的离子结构示意图是_____________,F元素原子的价电子构型的电子排布图(轨道表示式)是__________________,H元素的基态原子核外电子排布式是 。
(4)G的高价阳离子的溶液与H单质反应的离子方程式为 ;
与E元素成对角关系的某元素的最高价氧化物的水化物具有两性,写出该两性物质与D元素的最高价氧化物的水化物反应的化学方程式为 。
碳酸锂广泛应用于陶瓷和医药等领域,以锂辉石(主要成分为LiAlSi2O6)为原材料制备Li2CO3的工艺流程如下:
已知①2LiAlSi2O6+H2SO4 Li2SO4+Al2O3·4SiO2•H2O
Li2SO4+Al2O3·4SiO2•H2O
②Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的PH分别为3.2、4.7、9.0和11.1
③某些物质的溶解度(S)如下表
请回答下列问题:
(1)锂辉石用浓硫酸浸取之前要粉碎成细颗粒的目的是 。
(2)滤液a中含有Li+、SO42-,另含有Fe3+、Al3+、Fe2+、 Mg2+ 、Ca2+ 、Na+等杂质,步骤Ⅱ需在搅拌下加入石灰石以调节溶液的PH到6.0—6.5,此时沉淀的杂质离子有 ;石灰石调节溶液PH的原理的离子方程式为 。
(3)步骤Ⅱ在滤液a中加入的除杂剂依次为适量的H2O2溶液,石灰乳和Na2CO3溶液,发生氧化还原反应的离子方程式为 。
(4)步骤Ⅲ中加入饱和Na2CO3溶液过滤后需要用热水洗涤的原因是 。
(5)从滤液c中可回收的主要物质是 。