(A)现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| 层上有2对成对电子 |
|
| 最外层电子数是次外层电子数的2倍 |
|
| 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
|
| 元素最高正价是+7价 |
(1)元素的原子最外层共有种不同运动状态的电子。元素的一种同位素可测定文物年代,这种同位素的符号是
(2)元素与氢元素形成一种离子,写出该微粒的电子式(用元素符号表示)
(3)元素与元素相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是
a.常温下的单质和的单质状态不同 b.的氢化物比的氢化物稳定
c.一定条件下和的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。、、、四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是,理由是 。
(B)现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| 单质能与水剧烈反应,所得溶液呈弱酸性 |
|
| 层电子数比电子数多2个 |
|
| 第三周期元素的简单离子中半径最小 |
|
| 层有三个未成对电子 |
(1)写出元素的离子结构示意图。
写出元素的气态氢化物的电子式(用元素符号表示)
(2)写出元素最高价氧化物水化物的电离方程式
(3)元素与氯元素相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是
a.常温下氯气的颜色比单质的颜色深
b.的单质通入氯化钠水溶液不能置换出氯气
c.氯与形成的化合物中氯元素呈正价态
(4)探寻物质的性质差异性是学习的重要方法之-。、、、四种元素的单质中化学性质明显不同于其他三种单质的是,理由。
第三周期元素A、B、C,其原子序数逐渐增大,已知三种原子最外层共有10个电子,这三种元素的最高价氧化物的水化物有一种具有两性,且它们最高价氧化物的水化物两两之间都能反应生成盐和水,则:
(1)指出C元素在周期表中的位置
(2)写出B原子的结构示意图
(3)A和C形成的化合物的电子式为,属于晶体
(4)写出单质B和A的最高价氧化物的水化物反应的离子方程式。
(1)0.3 mol气态高能燃料乙硼烷(分子式为B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ的热量,写出上述燃烧反应的热化学方程式:
;
(2)配平下列反应方程式:
□Na2SO3+□KIO3+□H2SO4=□Na2SO4+□K2SO4+□I2+□H2O
近年来,由于石油价格不断上涨,以煤为原料制备一些化工产品的前景又被看好。下图是以煤为原料生产聚氯乙烯(PVC)和人造羊毛的合成路线。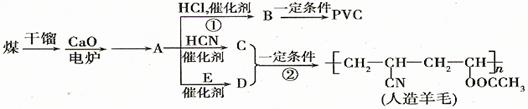
请回答下列问题:
(1)写出反应类型:反应①反应②。
(2)写出结构简式:PVC C。
(3)写出A D的化学反应方程式。
D的化学反应方程式。
(4)与D互为同分异构体且可发生碱性水解的物质有种(不包括环状化合物),
写出其中一种的结构简式。
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
⑴冶炼铜的反应为
8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是(填元素符号)。
⑵上述冶炼过程产生大量SO2。下列处理方案中合理的是(填代号)。
a.高空排放 b.用于制备硫酸 c.用纯碱溶液吸收制Na2SO4 d.用浓硫酸吸收
⑶过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2: S2O82-+2I-=2SO42-+I2
通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应催化的过程。、(不必配平)
⑷利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
a.除去Al3+的离子方程式是。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液碘水
所选试剂为。
证明炉渣中含有FeO的实验现象为。
下图是工业生产硝酸铵的流程。

(1)吸收塔C中通入空气的目的是。A、B、C、D四个容器中的反应,属于氧化还原反应的是(填字母)。
(2)已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=一1266.8kJ/mol
N2(g)+O2(g)=2NO(g)△H=+180.5 kJ/mol
写出氨高温催化氧化的热化学方程式:,氨催化氧化反应的化学平衡常数表达式K=。
(3)已知:N2(g)+3H2(g) 2NH3(g) △H= 一92 kJ/mol。为提高氢气的转化率,宜采取的措施有。(填字母)
2NH3(g) △H= 一92 kJ/mol。为提高氢气的转化率,宜采取的措施有。(填字母)
A.升高温度 B.使用催化剂 C.增大压强
D.循环利用和不断补充氮气 E.及时移出氨
(4)在一定温度和压强下,将H2和N2按3:1(体积比)在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的气体体积分数为17.6%,此时H2的转化率
为。