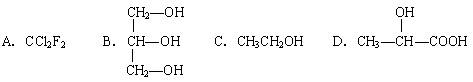下列离子方程式书写正确的是 ( )
| A.碳酸钙与盐酸反应 CO32-+2H+=CO2↑+H2O |
| B.硫酸和氯化钡溶液反应 Ba2++SO42-=BaSO4↓ |
| C.氢氧化铜和硫酸反应 OH-+H+=H2O |
| D.铁钉放入硫酸铜溶液中 Fe+3Cu2+=2Fe3++3Cu |
下列物质属于醇类的是
A. |
B.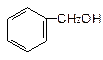 |
C. |
D.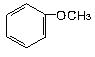 |
向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是
| A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 |
| B.在[Cu(NH3)4] 2+离子中,Cu2+给出孤对电子,NH3提供空轨道 |
| C.向反应后的溶液加入乙醇,溶液没有发生变化 |
| D.沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4] 2+ |
下面是一些原子的2p能级和3d能级中电子排布的情况,其中正确的是
下列说法正确的是
| A. HF、HCl、HBr、HI的熔点沸点依次升高。 |
| B. H2O的熔点、沸点大于H2S的是由于H2O分子之间存在氢键。 |
| C.乙醇分子与水分子之间只存在范德华力。 |
| D.氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4 |
下列化合物中含有手性碳原子的是