下列溶液中,跟100mL 0.5mol/L NaCl溶液所含的Cl-物质的量浓度相同的是( )
| A.100mL 0.5mol/L MgCl2溶液 | B.200mL 0.25mol/L AlCl3溶液 |
| C.50ml 1mol/L NaCl溶液 | D.25ml 0.5mol/L HCl溶液 |
以NA代表阿伏加德罗常数,则关于热化学方程式C2H2(g)+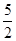 O2(g)
O2(g) 2CO2(g)+H2O(l)ΔH="-1" 300 kJ·mol-1的说法中,正确的是
2CO2(g)+H2O(l)ΔH="-1" 300 kJ·mol-1的说法中,正确的是
| A.当10NA个电子转移时,该反应放出1 300 kJ的能量 |
| B.当1NA个水分子生成且为液体时,吸收1300 kJ的能量 |
| C.当2NA个碳氧共用电子对生成时,放出1300 kJ的能量 |
| D.当8NA个碳氧共用电子对生成时,放出1300 kJ的能量 |
液氨与水性质相似,也存在微弱的电离:NH3 + NH3  NH4++ NH2-,其离子积常数k= c(NH4+)×c(NH2-)=2×10-30mol2·L2,维持温度不变,向液氨中加入NH4Cl固体或NaNH2固体,不发生改变的是
NH4++ NH2-,其离子积常数k= c(NH4+)×c(NH2-)=2×10-30mol2·L2,维持温度不变,向液氨中加入NH4Cl固体或NaNH2固体,不发生改变的是
| A.c(NH4+) | B.液氨的电离度 |
| C.c(NH2-) | D.液氨的离子积常数 |
298K下,将1mol蔗糖溶解在1L水中,此溶解过程中体系的∆G = ∆H-T∆S和∆S的变化情况是
| A.∆G>0,∆S<0 |
| B.∆G<0,∆S>0 |
| C.∆G>0,∆S>0 |
| D.∆G<0,∆S<0蔗糖从晶体变成溶液,混乱度增大,熵增加,故∆S>0. |
下列是4位同学在学习“化学反应速率和化学平衡”一章后,联系工业生产实际所发表的观点,你认为不正确的是
| A.化学反应速率理论是研究怎样在一定时间内快出产品 |
| B.化学平衡理论是研究怎样使用有限原料多出产品 |
| C.化学反应速率理论是研究怎样提高原料转化率 |
| D.化学平衡理论是研究怎样使原料尽可能多地转化为产品 |
Na2O、NaOH、Na2CO3、NaCl、Na2SO4可按某种标准划为同一类物质,下列分类标准正确的是
①钠的化合物 ②能与硝酸反应的物质 ③可溶于水的物质 ④电解质 ⑤钠盐 ⑥钠的含氧化合物
| A.①③④ | B.①②⑤⑥ | C.②⑤⑥ | D.①②④⑤ |