把含有(NH4)2SO4、NH4NO3的混合溶液a L分为两等份,一份中加入b mol KOH刚好把NH+4全部转化为NH3,另一份中加入c mol BaCl2恰好使沉淀完全,则原混合溶液中NO-3浓度是
A.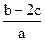 mol·L-1 mol·L-1 |
B. mol·L-1 mol·L-1 |
C.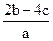 mol·L-1 mol·L-1 |
D.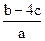 mol·L-1 mol·L-1 |
NA代表阿伏加德罗常数,下列有关叙述错误的是
| A.1mol 固体NaHSO4含有的阴阳离子总数为2NA |
| B.标准状况下22.4L CH4和C2H4的混合气体所含氢原子数为4NA |
| C.常温常压下,3.4gNH3中含N—H键数目为0.6NA |
| D.56 g铁粉在1mol氯气中充分燃烧,失去的电子数为3NA |
下列有关化学用语的表示正确的是
A.N2的电子式: |
B.CH4的比例模型: |
| C.中子数为45的溴原子:45 35Br |
D.对羟基苯甲酸的结构简式: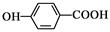 |
a molNa2O2和b molNaHCO3固体混合后,在密闭容器中加热到250℃,使其充分反应,当排出气体为两种气体时,a:b不可能为
| A.3:2 | B.4:5 | C.2:3 | D.3:4 |
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化如图所示,下列说法正确的是
| A.ab段发生的离子反应为:Al3++3OH-= Al(OH)3↓,Mg2++2OH-= Mg(OH)2↓ |
| B.原溶液中含有的阳离子必定有H+、NH4+、Al3+、Mg2+ |
| C.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 |
| D.d点溶液中含有的溶质只有NaAlO2 |
如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是
| A.K1闭合,铁棒上发生的反应为2H++2e-→H2↑ |
| B.K1闭合,石墨棒周围溶液pH逐渐升高 |
| C.K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法 |
| D.K2闭合,电路中通过0.4NA个电子时,两极共产生标况下4.48L气体 |