向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)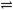 SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下图所示。由图可得出的正确结论是
SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下图所示。由图可得出的正确结论是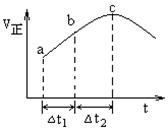
| A.反应在c点达到平衡状态 |
| B.反应物浓度:a点小于b点 |
| C.反应物的总能量低于生成物的总能量 |
| D.若△t1=△t2,则SO2的转化量:a~b段小于b~c段 |
下列表达方式错误的是()
A.甲烷的电子式 |
B.氟化钠的电子式 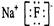 |
| C.硫离子的核外电子排布式 1s22s22p63s23p4 | D.碳-12原子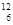 C C |
下列能级中轨道数为3的是()
| A.s能级 | B.p能级 | C.d能级 | D.f能级 |
下列离子检验的操作与现象不正确的是
| A.向少许待测液中滴加KSCN溶液无明显变化,再滴入氯水,溶液呈红色,则待测液中含有Fe2+ |
| B.向少许待测液中滴几滴稀硝酸,再滴加少许硝酸银,有白色沉淀生成,则待测液中含有Cl- |
| C.向少许待测液中逐滴加入稀氨水至过量,产生白色胶状沉淀,后又逐渐溶解,则待测液中含有Al3+ |
| D.用洁净的铂丝用盐酸清洗后在酒精灯外焰上灼烧至无色时蘸取待测液在外焰上灼烧,透过蓝色钴玻璃观察火焰为紫色,则待测液中含有K+ |
下表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是
| 选项 |
陈述Ⅰ |
陈述Ⅱ |
判断 |
| A |
盛放氢氧化钠溶液的试剂瓶用橡胶塞 |
氢氧化钠可以与玻璃中的二氧化硅反应生成粘性的硅酸钠 |
Ⅰ对,Ⅱ错,无 |
| B |
氯水可以使有色布条褪色 |
氯气具有漂白性 |
Ⅰ错,Ⅱ对,有 |
| C |
二氧化硅可以与水反应生成硅酸 |
二氧化硅是酸性氧化物具有酸性氧化物的通性 |
Ⅰ对,Ⅱ对,无 |
| D |
为增强漂白能力使用漂白粉时向漂白粉溶液中加入少量白醋 |
醋酸的酸性比次氯酸强 |
Ⅰ对,Ⅱ对,有 |
下列各组离子中,能在溶液中大量共存的是
| A.OH-Na+HCO3- Cl- | B.Ba2+ Na+Cl- SO42- |
| C.K+ Al3+ SO42-OH- | D.Ag+ Al3+ NO3-H+ |