下列所述事实与化学(或离子)方程式不相符的是 ( )
A.能说明NH3结合H+能力比H2O强:N H3+H2O H3+H2O NH4++OH- NH4++OH- |
| B.能说明氧化性H2O2>Fe3+:2Fe2++H2O2+2H+=2Fe3++2H2O |
| C.能说明盐酸的酸性比碳酸强:2HCl+CaCO3=CaCl2+H2O+CO2↑ |
D.能说明CH3COPH是弱酸:CH3COO-+H2O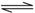 CH3COOH+OH- CH3COOH+OH- |
某光卤石(KCl·MgCl2·6H2O)样品中含有不跟NaOH溶液、盐酸反应的杂质,为测定样品中KCl·MgCl2·6H2O的质量分数,有如下操作:
| A.称取a g样品,放入锥形瓶中加适量水溶解。 |
| B.往锥形瓶中加入bmol·L-1的NaOH溶液100mL(过量),振荡。 |
| C.过滤并冲洗沉淀2—3次,收集滤液及洗液于锥形瓶中。 |
| D.往沉淀中滴加cmol·L-1的稀HCl溶液至沉淀溶解,消耗盐酸V1mL。 |
E.用cmol·L-1的盐酸滴定过量的NaOH至终点,消耗盐酸V2mL。
F.向步骤B锥形瓶中加入指示剂2-3滴。
G.向步骤C锥形瓶中加入指示剂2-3滴。
回答:
(1)正确且必要的操作顺序是____。(填序号)
(2)KCl.MgCl2·6H2O质量分数是____。
证明某溶液是否只含有Fe2+而不含有Fe3+的实验方法是
| A.先滴加氯水,再滴加KSCN溶液后显红色 |
| B.先滴加KSCN溶液,再滴加氯水后显红色 |
| C.滴加NaOH溶液,先产生白色沉淀,后变灰绿,最后呈红褐色 |
| D.只需滴加KSCN溶液 |
在元素周期表中,对于相同主族相邻周期的两种元素原子序数之差的叙述正确的是
| A.第2、3周期两元素相差均为8 |
| B.第3、4周期两元素相差均为18 |
| C.第5、6周期两元素相差均为32 |
| D.以上叙述均正确 |
下列叙述正确的是
| A.两种微粒,若核外电子排布完全相同,则化学性质一定相同 |
| B.由单原子形成的离子,一定具有稀有气体元素原子核外电子排布 |
| C.两原子,如果核外电子排布相同,则一定属于同一种元素 |
| D.阴离子的核外电子排布一定与上一周期稀有气体原子核外电子排布相同 |
把NaOH溶液和CuSO4溶液加入某人的尿液中,微热时如果观察到红色沉淀,说明该尿液中含有
| A.食醋 |
| B.白酒 |
| C.食盐 |
| D.葡萄糖 |