已知质量数为A的某阴离子Rn-,核外有X个电子,则核内中子数为
| A.A-x | B.A-x-n | C.A-x+n | D.A+x-n |
通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。现给出化学键的键能(见下表):
| 化学键 |
H—H |
Cl—Cl |
Cl—H |
| 键能/(kJ·mol-1) |
436 |
243 |
431 |
请计算H2(g)+Cl2(g)===2HCl(g)的反应热( )
A.+862 kJ·mol-1 B.+679 kJ·mol-1
C.-183 kJ·mol-1 D.+183 kJ·mol-1
关于如图所示装置的叙述,正确的是( )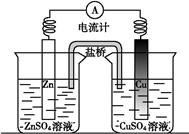
| A.铜是正极,铜片上有气泡产生 | B.铜片质量逐渐减少 |
| C.电流从锌片经导线流向铜片 | D.铜离子在铜片表面被还原 |
已知:C(s)+ 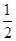 O2(g)
O2(g) CO(g)ΔH1 = —110.5 kJ/mol
CO(g)ΔH1 = —110.5 kJ/mol
CO(g)+ 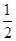 O2(g)
O2(g) CO2(g) ΔH2 = —283.0 kJ/mol
CO2(g) ΔH2 = —283.0 kJ/mol
则反应C(s)+O2(g) CO2(g)的反应热为( )
CO2(g)的反应热为( )
| A.172.5 kJ/mol | B.—172.5 kJ/mol | C.393.5 kJ/mol | D.—393.5 kJ/mol |
由右图分析,有关叙述正确的是( )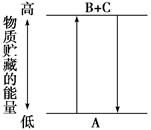
| A.A→B+C和B+C→A两个反应吸收或放出的能量数值不相等 |
| B.A→B+C是放热反应 |
| C.A具有的能量高于B和C具有的能量总和 |
| D.A→B+C是吸热反应,则B+C→A必然是放热反应 |
已知25 ℃、101 kPa下,石墨、金刚石燃烧的热化学方程式分别为:
C(石墨)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1①
C(金刚石)+O2(g)===CO2(g) ΔH=-395.4 kJ·mol-1②
据此判断,下列说法正确的是( )
| A.由石墨制备金刚石是吸热反应;石墨的能量比金刚石的低 |
| B.由石墨制备金刚石是吸热反应;石墨的能量比金刚石的高 |
| C.由石墨制备金刚石是放热反应;石墨的能量比金刚石的低 |
| D.由石墨制备金刚石是放热反应;石墨的能量比金刚石的高 |