关于化学键的下列叙述中正确的是( )
| A.离子化合物不可能含共价键 | B.共价化合物可能含离子键 |
| C.离子化合物中只含离子键 | D.共价化合物中不含离子键 |
下列物质中属于同系物的是()
①CH3CH2Cl②CH2="=CHCl" ③CH3CH2CH2Cl④CH2ClCH2Cl⑤CH3CH2CH2CH3
⑥CH3CH(CH3)2
| A.①② | B.①④ | C.①③ | D.⑤⑥ |
下列化合物中,既能发生消去反应生成烯烃,又能发生水解反应的是()
A.CH3Cl
 D.CH3CH2CH2Br
D.CH3CH2CH2Br
如图6-1所示,C8H8的分子呈正六面体结构,因而称为“立方烷”。它的六氯代物的同分异构体共有( )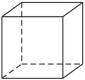
图6-1
| A.3种 | B.4种 | C.6种 | D.12种 |
氯丹是一种广效性杀虫剂,其结构简式如下图。下列关于氯丹的叙述正确的是( )
| A.氯丹组成中氢、氯、碳原子个数比为3:4:5 |
| B.氯丹的分子式为C10H4Cl8 |
| C.氯丹属于芳香族化合物 |
| D.氯丹既能溶于水也能溶于有机溶剂,所以才有其广效性 |
修正液(俗称涂改液)白色纯正、反射率高且使用方便,复印时常用于对文稿的修改。目前有许多中小学生使用修正液,用于修改笔记、作业等。由于修正液中含有挥发性的有毒溶剂,教师应告诫学生不要使用。修正液中所含的有毒成分可能是( )
| A.乙醇 | B.醋酸 |
| C.一氯甲烷 | D.三氯乙烯 |