同学们已经学习了几种典型的有机化学反应类型——取代反应、加成反应、酯化反应等,写出下列反应的化学反应方程式,并判断其反应类型。
①由乙烯制氯乙烷: ,属于 反应;
②由苯制取硝基苯: ,属于 反应;
③由苯制取环己烷: ,属于 反应;
铬铁矿主要成分为FeO·Cr2O3,含有SiO2、Al2O3等杂质。工业上用铬铁矿制备红矾钠(Na2Cr2O7)的流程如下图所示: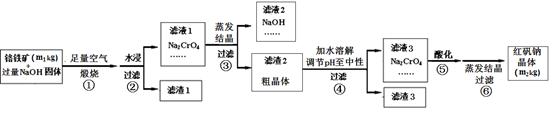
煅烧时反应为:4 FeO·Cr2O3+7 O2 +20 NaOH 8 Na2CrO4 + 4 NaFeO2+10 H2O
8 Na2CrO4 + 4 NaFeO2+10 H2O
(1)步骤①是在坩埚中进行煅烧,可用作此坩埚材料的是。
| A.铁 | B.氧化铝 | C.石英 | D.陶瓷 |
(2)步骤①煅烧反应极慢,需要升温至NaOH呈熔融状态,反应速率才加快,其原因为______。
(3)步骤②中NaFeO2会强烈水解生成氢氧化铁沉淀,其化学方程式为。
(4)将五份滤液1分别在130℃蒸发1小时,各自冷却到不同温度下结晶,保温过滤,所得实验数据如下表。根据数据分析,步骤③的最佳结晶温度为___________。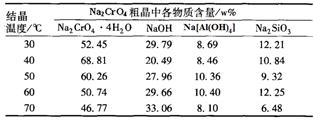
(5)步骤④中滤渣3的成分是_________________________。
(6)假设该流程中铬元素完全转化为红矾钠,则该铬铁矿中铬元素的质量分数为_____(用含m1、m2的代数式表示)。
已知A、B、C、D是中学化学常见物质,它们在一定条件下有A+B→C+D的转化关系。
(1)若A为金属铝,B为氧化铁,该反应的一种用途是。
(2)若A是一种能使湿润的红色石蕊试纸变蓝的气体,且该反应是工业上制取硝酸的重要反应之一,该反应的化学反应方程式为。
(3)若A是淡黄色粉末,常用作供氧剂,C为强碱,则该反应的化学反应方程式为。
(4)若A、B、D都是有机化合物,其中A、B是家庭厨房
中常见调味品的主要成分,且A的相对分子质量比B大14。
①反应的化学反应方程式为。
②某种以B为反应物的新型电池如图所示,该电池的负极的电极反应式为。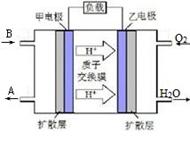
元素周期表中第三周期元素的单质及其化合物的用途广泛。
(1)该周期元素中,半径最小的简单离子的离子结构示意图为。
(2)能证明氯的非金属性(得电子能力)比硫强的化学方程式为。
(3)NaHSO3溶液呈酸性,其溶液中离子浓度由大到小的顺序为。
(4)ClO2可将弱酸性废水中的Mn2+转化为MnO2而除去,同时ClO2被还原为Cl—,该反应的离子方程式为。
(5)已知下列两反应过程中能量变化如图所示: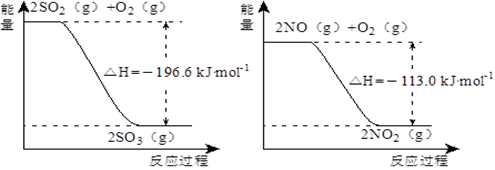
汽车尾气中含有的少量NO2和SO2在一定条件下会发生反应,该反应的热化学方程式为____________。
现有含NaCl、Na2SO4、Na2CO3和NaHCO3的固体混合物。某同学为测定其中各组分的含量,取部分样品溶于水,并设计了如下实验流程(所加试剂均为过量,反应①~③均为复分解反应)。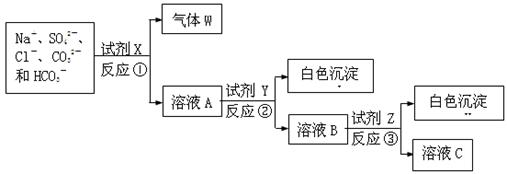
请回答: (1)气体W的化学式是。
(1)气体W的化学式是。
(2)反应①的离子方程式是 。
。
(3)试剂X、Y、Z依次是。
(4)下列说法正确的是(填字母) 。
。
a.溶液A的焰色反应为黄色
b.反应②和③之后均需进行过滤操作
c.若测得气体W的体积(标准状况)、白色沉淀Ⅰ和Ⅱ的质量,可计算出各组分的量
实验室欲配制500mL 0.5mol/L的NaOH溶液,有以下仪器:
(1)实验中需要称量NaOH 固体的质量是 。
(2)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为(填序号)____________________________。
(3)在配制过程中,如果没有洗涤烧杯和玻璃棒,其他操作都正确的,那么所配溶液的实际浓度将(填大于、小于或等于)0.5mol/L 。