有下列各组微粒或物质:
A.O2和 O3 O3 |
B.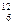 C和 C和 C C |
C.CH3CH2CH2CH3和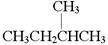 |
D. E.CH3CH2CH2CH3和 E.CH3CH2CH2CH3和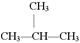 |
(1) 组两种微粒互为同位素;
(2) 组两种物质互为同素异形体;
(3) 组两种物质属于同系物;
(4) 组两物质互为同分异构体;
(5) 组两物质是同一物质。
A为药用有机物,从A出发可发生图3-1所示的一系列反应。已知A在一定条件下能跟醇发生酯化反应,A分子中苯环上的两个取代基连在相邻的碳原子上;D不能跟NaHCO3溶液反应,但能跟NaOH溶液反应。
图3-1
试完成:
(1)A转化为B、C时,涉及到的反应类型有____________、____________。
(2)E的两种同分异构体Q、R都能在一定条件下发生银镜反应,R能跟金属钠反应放出氢气,而Q不能。Q、R的结构简式分别为:Q____________,R____________。
(3)气体X的化学式为____________,D的结构简式为____________。
(4)A在加热条件下与NaOH溶液反应的化学方程式为:________________________。
在新型有机高分子材料中,有一种感光高分子材料,也称为光敏高分子,是一种在彩电光屏及大规模集成电路的制造中使用的功能高分子材料,其结构简式为:
已知它是由两种化合物经酯化后聚合而成的,这两种化合物的结构简式为:__________________________。
使用某些有机物材料给环境造成“白色污染”,后果严重。最近研究的一些分解性塑料,有良好的生物适应性和分解性,能自然腐烂分解。如:
已知3HB的单体叫3羟基丁酸,则:
(1)4HB的名称是_______________,3HV的名称是_______________________。
(2)两分子4HB的单体脱水时,生成的环酯的结构简式为____________________。
二氯烯丹是一种播前除草剂,其合成路线如下: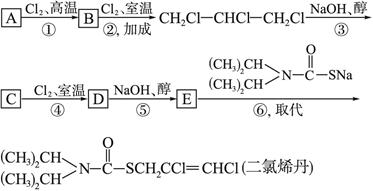
且D在反应⑤中所生成的E,其结构只有一种可能。
(1)写出下列反应的类型:反应①是____________,反应③是____________。
(2)写出下列物质的结构简式:A:____________,C:____________,D:____________,E:____________。
2000年,国家药品监督管理局发布通告暂停使用和销售含苯丙醇胺的药品制剂。苯丙醇胺(英文缩写为PPA)结构简式如下: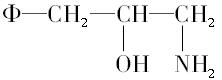
其中Φ-代表苯基。
(1)PPA的分子式是____________。
(2)它的取代基中有两个官能团,名称是____________基和____________基。(请填写汉字)
(3)将Φ—、H2N—、HO—在碳链上的位置作变换,可以写出多种同分异构体,其中的5种结构简式分别如下: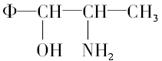
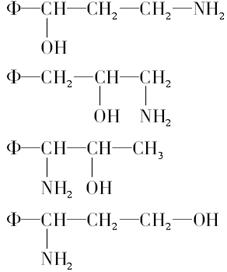
请写出另外4种同分异构体的结构简式(不要写出—OH和—NH2连在同一个碳原子上的异构体)__________、_______________、___________________、_____________