(共7分)某同学设计了下图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:
(1)若A为浓氨水,B为氧化钙,C中盛有AlCl3溶液,旋开活塞E,足够长时间后,观察到C中的现象为 ,圆底烧瓶中发生反应的化学方程式为 ;
(2)若A为30%的H2O2溶液,B为二氧化锰,C中盛有酸化过的FeCl2溶液,旋开活塞E后,C中的现象为 ,圆底烧瓶中发生反应的化学方程式为 ;
(3)利用上述装置还可以验证SO2的化学性质, A为较浓硫酸,B为亚硫酸钠,则C中盛有
溶液可验证SO2的氧化性; C中盛有 溶液可验证其还原性; 而C中盛有 溶液可验证其漂白性。
钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属。目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4:
2FeTiO3+7Cl2+6C 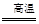 2TiCl4+2FeCl3+6CO
2TiCl4+2FeCl3+6CO
TiO2+2Cl2+2C 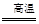 TiCl4+2CO
TiCl4+2CO
将TiCl4蒸馏并提纯,在氩气保护下与镁共热得到钛:TiCl4+2Mg 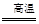 Ti+2MgCl2
Ti+2MgCl2
MgCl2和过量Mg用稀盐酸溶解后得海绵状钛,再在真空熔化铸成钛锭。
请回答下列问题:
(1)基态钛原子的价电子排布式为_________。
(2)与CO互为等电子体的离子为_______(填化学式)。
(3)在CH2Cl2、C6H6、CO2、C2H4中,碳原子采取sp杂化的分子有___________。
(4)TiCl4在常温下是无色液体,在水或潮湿空气中易水解而冒白烟。则TiCl4属于__________(填“原子”、“分子”或“离子”)晶体。
(5)与钛同周期的另一种元素钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,现象是_______;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为_________。
据报道科研人员应用计算机模拟出结构类似C60的物质N60。已知:①N60分子中每个氮原子均以N—N键结合三个N原子而形成8电子稳定结构;②N—N键的键能为167 kJ•mol-1。请回答下列问题。
(1)N60分子组成的晶体为_______晶体,其熔、沸点比N2________(填“高”或“低”),原因是_________
(2)1 mol N60分解成N2时吸收或放出的热量是_______________________________
kJ(已知N≡N键的键能为942 kJ•mol-1),表明稳定性N60________(填“>”、“<”或“=”)N2。
(3)由(2)列举N60的用途(举一种) ______________
(10分) 纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。
(1)A和B的单质单位质量的燃烧热大,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
①某同学根据上述信息,推断B的核外电子排布如图所示,该同学所画的电子排布图违背了。
②根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为。
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
①已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由。
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。该物质的K原子和C60分子的个数比为。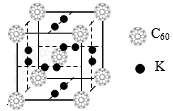
③继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为。
下图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素,A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为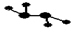 ,C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2。根据以上信息回答下列问题:
,C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2。根据以上信息回答下列问题: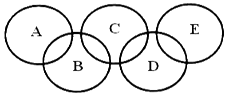
①B的水溶液呈弱酸性,其主要的电离方程式可表示为_________,D的化学式是_______。
②A、B、E中均含有的一种元素为___________ (填元素名称) 。
③E电子式为_________________。
④液态B与液态E反应可生成一种气态单质和一种常见液体,1molB参加反应放出热量QkJ,其反应的热化学方程式为_______ _______。
⑤NH3分子中的N原子有一对孤对电子,能发生反应:NH3+HCl=NH4Cl。试写出E与足量盐酸时,发生反应的化学方程式。
现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图所示的结构或结构单元,(图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同)。A、B的晶体类型相同。单质A的同素异形体能与B物质发生置换反应。C、D、E、F含有相等的电子数,且D是阳离子,D与F的组成元素相同。C、E、F的晶体类型相同,由E构成的物质常温下呈液态。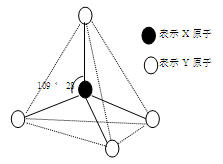
(1)写出单质A的同素异形体与B物质发生置换反应的化学方程式____________;与A同主族的第四周期元素基态原子的外围电子排布式为 。
(2)上述六种物质或粒子的组成元素中有三种处于同一周期,请写出这三种元素第一电离能由大到小的顺序(用元素符号回答)
(3)上述六种物质或粒子中互为等电子体的是(写出化学式)
(4)F分子的中心原子杂化类型是,E易溶于F,其原因是。