现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图所示的结构或结构单元,(图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同)。A、B的晶体类型相同。单质A的同素异形体能与B物质发生置换反应。C、D、E、F含有相等的电子数,且D是阳离子,D与F的组成元素相同。C、E、F的晶体类型相同,由E构成的物质常温下呈液态。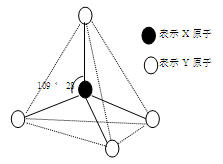
(1)写出单质A的同素异形体与B物质发生置换反应的化学方程式____________;与A同主族的第四周期元素基态原子的外围电子排布式为 。
(2)上述六种物质或粒子的组成元素中有三种处于同一周期,请写出这三种元素第一电离能由大到小的顺序 (用元素符号回答)
(3)上述六种物质或粒子中互为等电子体的是 (写出化学式)
(4)F分子的中心原子杂化类型是 ,E易溶于F,其原因是 。
室安卡因(G)是一种抗心率天常药物,可由下列路线合成;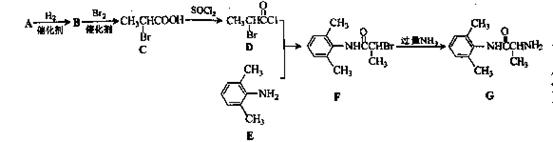 (1)已知A是
(1)已知A是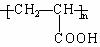 的单体,则A中含有的官能团是(写名称)。B的结构简式是。
的单体,则A中含有的官能团是(写名称)。B的结构简式是。
(2)C的名称(系统命名)是,C与足量NaOH醇溶液共热时反应的化学方程式是。
(3)X是E的同分异构题,X分子中含有苯环,且苯环上一氯代物只有两种,则X所有可能的结构简式有种
(4)F→G的反应类型是。
(5)下列关于室安卡因(G)的说法正确的是。
a.能发生加成反应b.能使酸性高锰酸钾溶液褪色
c.能与盐酸反应生成盐d..属于氨基酸
下图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。已知:①反应C+G B+H能放出大量的热,该反应曾应用于铁轨的焊接;②I是一种常见的温室气体,它和E可以发生反应:2E+I
B+H能放出大量的热,该反应曾应用于铁轨的焊接;②I是一种常见的温室气体,它和E可以发生反应:2E+I 2F+D,F中E元素的质量分数为60%。
2F+D,F中E元素的质量分数为60%。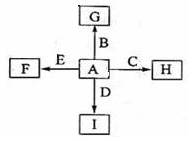
回答问题:
⑴①中反应的化学方程式为;
⑵化合物I的电子式为,它的空间结构是;
⑶1.6gG溶于盐酸,得到的溶液与铜粉完全反应,至少所需的铜粉的质量为,
⑷C与过量NaOH溶液反应的离子方程为,反应后的溶液与过量化合物I反应的离子方程式为;
⑸E在I中燃烧观察到的现象是。
⑹G的化学式是。
高效净水剂聚合氯化铝铁(PAFC)的组成可表示为[AlFe(OH)nCl6-n]m,该物质广泛应用于
日常生活用水 和工业废水的处理。
和工业废水的处理。
(1)为检测PAFC中Al和Fe含量,采用如图所示流程进行。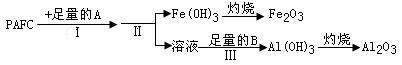
回答下 列问题:
列问题:
①PAFC中铁元素的化合价为_________。
②步骤I中的试剂A是_________(填“氨水”或“氢氧化钠溶液”)。
③步骤Ⅱ的名称是。
④步骤Ⅲ的离子方程式为___________________________________。
(2)某工厂欲以工业废料(金属铝、铁及其氧化物)为原料制取PAFC,设计如下流程:
①所得酸性溶液中,不能确定是否一定存在的阳离子是___________
A、Al3+B、Fe2+C、Fe3+D、H+
为证明该离子确实存在,可采用的试剂是_____________________。
②往酸性 溶液中加入试剂X的目的是_________________________________。
溶液中加入试剂X的目的是_________________________________。
(3分)1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH等于_______
⑴浓度均为0.1mol/L的8种溶液:① HNO3② H2SO4③ CH3COOH ④ Ba(OH)2 ⑤NaOH⑥ CH3COONa⑦ KCl⑧ NH4Cl,溶液pH值由小到大的顺序是(填写编号) ________________。
(2)氯化铝水溶液呈性,原因是(用离子方程式表示):,把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是(写化学式)。