现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下转化关系(图中有些反应的产物和反应的条件没有全部标出)。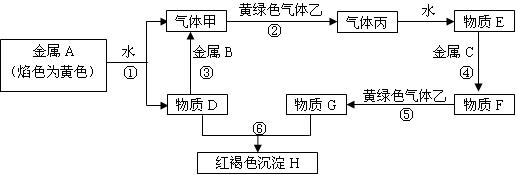
请根据图中信息回答下列问题:
(1)写出下列物质的化学式:B ________、C________、H _________、丙__________
(2)写出下列反应离子方程式:
反应①____________________ 反应③__________________________
(3)反应⑤属于下列反应类型中_______________(填写序号)。
A.氧化还原反应 B.分解反应 C.化合反应 D.复分解反应
【化学—物质结构与性质】石墨烯(图甲)是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(图乙)
(1)图甲中,1号C与相邻C形成 键的个数为____________________________。
键的个数为____________________________。
(2)图乙中,1号C的杂化方式是________________,该C与相邻C形成的键角_______(填“>”“<”或“=”)图甲中1号C与相邻C形成的键角。
(3)若将图乙所示的氧化石墨烯分散到H2O中,则氧化石墨烯可与H2O形成氢键的原子有_________(填元素符号)。
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图所示,M原子位于晶胞的棱上与内部,该晶胞中M原子的个数为_____________,该材料的化学式为__________。
【化学—选修2:化学与技术】化学是人类进步的关键,化学为人类的生产、生活提供了物质保证。氮的化合物是重要的化工原料,在工农业生产中有很多重要应用。工业上合成氨的流程示意图如下:
回答下列问题:
(1)25℃时合成氨反应热化学方程式为:N2(g)+3H2(g) 2NH3(g)ΔH=-92.4kJ/mol。在该温度时,取1molN2和3molH2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是小于92.4kJ。其原因是___________________________________________________________。
2NH3(g)ΔH=-92.4kJ/mol。在该温度时,取1molN2和3molH2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是小于92.4kJ。其原因是___________________________________________________________。
(2)原料氢气的来源是水和碳氢化合物,写出工业生产中分别采用煤和天然气为原料制取氢气的化学反应方程式:___________________________,。
(3)设备B的名称________________,其中m和n是两个通水口,入水口是(填“m”或“n”),不宜从相反方向通水的原因_________________________________。
(4)设备C的作用是____________________________________________________。
(5)为了提高其产量,降低能耗,近年有人将电磁场直接加在氮气与氢气反应的容器内,在较低的温度和压强条件下合成氨,获得了较好的产率。从化学反应本质角度分析,电磁场对合成氨反应的作用是_________________________________________________________________________________;
与传统的合成氨的方法比较,该方法的优点是________________________________________。
目前“低碳经济”正成为科学家研究的主要课题。请回答下列问题:
I.甲烷自热重整是一种先进的制氢方法,其反应方程式为:CH4(g) + H2O(g)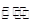 CO(g) + 3H2(g)
CO(g) + 3H2(g)
(1)阅读下图,计算该反应的反应热ΔH = _______________kJ/mol。
II.用CH4或其他有机物、O2为原料可设计成燃料电池。
(2)以CnH2nOn、O2为原料,H2SO4溶液为电解质设计成燃料电池,则负极的电极反应式为______________。
(3)以CH4、O2为原料,100 mL 0.15 mol/L NaOH溶液为电解质设计成燃料电池,若放电时参与反应的氧气体积为448 mL(标准状况),产生的气体全部被溶液吸收,则所得溶液中溶质的成分及物质的量之比为____________________,各离子浓度由大到小的顺序为________________________________________。
III.利用I2O5消除CO污染的反应为:5CO(g) + I2O5(s)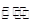 5CO2(g) + I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 mol CO,测得CO2的体积分数随时间t变化曲线如图。请回答:
5CO2(g) + I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 mol CO,测得CO2的体积分数随时间t变化曲线如图。请回答:
(4)T2时,0 ~ 0.5 min内的反应速率v(CO) = ____________________。
(5)T1时化学平衡常数K = _________________________。
(6)下列说法不正确的是____________________(填字母序号)。
| A.容器内气体密度不变,表明反应达到平衡状态 |
| B.两种温度下,c点时体系中混合气体的压强相等 |
| C.d点时,增大体系压强,CO的转化率不变 |
| D.b点和d点时化学平衡常数的大小关系:Kb < Kd |
IV.(7)电解CO制备CH4和W,工作原理如图所示,其原理用电解总离子方程式解释是_____________。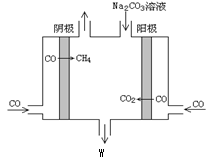
【化学选修3:物质结构与性质】A、B、C、D、E是元素周期表中前四周期中五种常见元素,其相关信息如下表:
| 元素 |
相关信息 |
| A |
原子核外L层电子数是K层的2倍 |
| B |
其一种单质被称为地球生物的“保护伞” |
| C |
元素的第一电离能是第3周期所有元素中最小的 |
| D |
基态原子最外层电子排布为(n+1)sn(n+1)p(n+2) |
| E |
可形成多种氧化物,其中一种为具有磁性的黑色晶体 |
请回答下列问题:
(1)C在元素周期表中位于第周期、第族;D的基态原子核外电子排布式是。
(2)B、C、D的简单离子半径由大到小的顺序为(用化学符号表示,下同),B、D的简单氢化物中稳定性较大的是。
(3)B的常见单质和C的单质按物质的量比1∶2反应生成的化合物中化学键的类型为;该化合物属于晶体。
(4)E形成的黑色磁性晶体发生铝热反应的化学方程式是。
(5)已知:2AB(g)+B2(g) 2AB2(g) ΔH="-566.0" kJ·mol-1
2AB2(g) ΔH="-566.0" kJ·mol-1
D(s)+B2(g) DB2(g)ΔH="-296.0" kJ·mol-1
DB2(g)ΔH="-296.0" kJ·mol-1
处理含AB、DB2烟道气污染的一种方法是将其在催化剂作用下转化为固态单质D,请写出此反应的热化学方程式:。
【化学选修2:化学与技术】火山喷发所产生的硫黄可用于生产重要的化工原料硫酸。某企业用下图所示的工艺流程生产硫酸: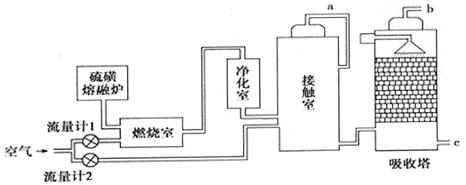
请回答下列问题:
(1)硫酸的用途非常广泛,可应用于下列哪些方面_(可多选)
| A.橡胶的硫化 |
| B.表面活性剂“烷基苯磺酸钠”的合成 |
| C.铅蓄电池的生产 |
| D.过磷酸钙的制备 |
(2)为充分利用反应放出的热量,接触室中应安装______(填设备名称)。吸收塔中填充有许多瓷管,其作用是 .
(3)如果进入接触室的混合气(含SO2体积分数为7%、O2为11%、N2为82%)中SO2平衡转化率与温度及压强的关系如图所示。在实际生产中,SO2催化氧化反应的条件选择常压和450℃,而没有选择SO2转化率更高的B或C点对应的反应条件,其原因分别是_______;。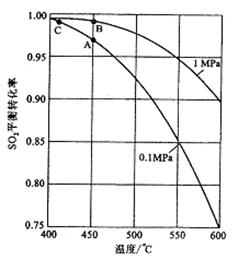
(4)为使硫黄充分燃烧,经流量计l通入燃烧室的氧气过量50%;为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍;则生产过程中流经流量计l和流量计2的空气体积比应为。假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为(空气中氧气的体积分数按0.2计),
(5)工业对硫酸厂尾气的处理方法一般是。