(1)在下面元素周期表中全部是金属元素的区域为 。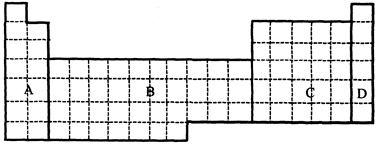
(a)A (b)B (c)C (d)D
(2)短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子数的2倍;Y元素单质为双原子分子,其氢化物水溶液呈碱性;1mol单质Z跟盐酸完全反应,能置换出22.4L的H2(标准状况);W元素原子核外M层电子数目比K层多1个;
①请写出元素X的一种核素的化学符号 ;
②写出元素Y在周期表中的位置 ;
③Z、W两元素相比较,金属性较强的元素是 (填元素符号),可以验证该结论的实验是 。
(a)比较两种元素单质的熔点
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)比较这两种元素的最高价氧化物对应水化物的碱性
(d)比较这两种元素的气态氢化物的稳定性
(1)用食用油炒咸菜的铁锅如果没有洗净,不久会出现红褐色锈斑。则铁锅的锈蚀属于腐蚀(填“析氢”或“吸氧”);该腐蚀正极的电极反应式为;
此反应每转移2mol电子消耗的O2在标准状况下的体积为L。
(2)某同学用碳棒、铜棒和稀硫酸为原材料,实现了在通常条件下不能发生的反应:Cu+H2SO4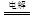 CuSO4+H2↑请在右边方框中画出能够实验这一反应的装置图(作必要的标注);某同学做该实验时,看到碳棒上有气泡产生,铜棒上气泡更多且没有被腐蚀,其原因是。
CuSO4+H2↑请在右边方框中画出能够实验这一反应的装置图(作必要的标注);某同学做该实验时,看到碳棒上有气泡产生,铜棒上气泡更多且没有被腐蚀,其原因是。
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下
实验。请你完成下列填空:
步骤一:配制100mL 0.10mol/L NaOH标准溶液。.
步骤二:取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
| 实验编号 |
NaOH溶液的浓度 (mol/L) |
滴定完成时,消耗NaOH溶液的体积(mL) |
待测盐酸溶液的体积(mL) |
| 1 |
0.10 |
22.02 |
20.00 |
| 2 |
0.10 |
22.00 |
20.00 |
| 3 |
0.10 |
21.98 |
20.00 |
(1)滴定达到终点的现象是;此时锥形瓶内溶液的pH的范围是。
(2)根据上述数据,可计算出该盐酸的浓度为。
(3)排去碱式滴定管中气泡的方法应采用右图的操作,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
(4)在上述实验中,下列操作(其他操作正确)会造成
测定结果(待测液浓度值)偏高的有(漏选得1分,错选、多选得0分):
A. 配制标准溶液定容时,加水超过刻度
B. 锥形瓶水洗后直接装待测液
C. 酸式滴定管水洗后未用待测稀盐酸溶液润洗
D. 滴定到达终点时,仰视读出滴定管读数;
E. 碱式滴定管尖嘴部分有气泡,滴定后消失
向盛有1 mL 0.1 mol/L MgCl2溶液的试管中滴加2滴(1滴约0.05mL)2mol/L NaOH
溶液,有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,静置。可以观察到的现象是
,产生该现象的原因是。
(1)下列化学原理的应用,主要用沉淀溶解平衡原理来解释的
是:
①热纯碱溶液洗涤油污的能力比冷纯碱溶液强;②误将钡盐[BaCl2、Ba(NO3)2]当作食盐食用
时,常用0.5%的Na2SO4溶液解毒;③石灰岩(喀斯特地貌)的溶洞形成;④BaCO3不能做“钡餐”,而BaSO4则可以;⑤使用泡沫灭火器时“泡沫”生成的原理。
| A.②③④ | B.①②③ | C.③④⑤ | D.①②③④⑤ |
(2)氯化铝水溶液呈性 ,其离子方程式表示为;
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是。
下表是不同温度下水的离子积常数:
| 温度/℃ |
25 |
t1 |
t2 |
| 水的离子积常数 |
1×10-14 |
KW |
1×10-12 |
试回答以下问题:
(1)若25℃<t1<t2,则KW__________1×10-14(填“>”、“<”或“=”),判断的理由是
。
(2)25℃ 下,将pH=13的氢氧化钠溶液与pH=1的稀盐酸等体积混合,所得混合溶液的pH=__________。
(3)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈(填“酸性”、“中性”或“碱性”),溶液中c(Na+)c(CH3COO-)(填“>”、“=”或“<”)。
(4)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈性(填“酸”、 “中”或“碱”),溶液中c(Na+)c(CH3COO-)[填“>”、“=”或“<”] 。