下表为元素周期表中的一部分,表中列出了11种元素在周期表中的位置,按要求完成下列各小题。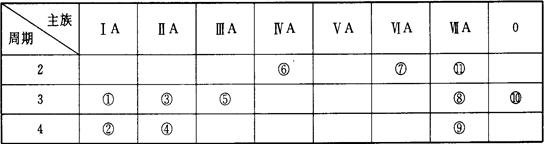
(1) 化学性质最不活泼的元素是 (填元素符号或化学式,下同),
非金属性最强的元素是 。
金属性最强的单质与水反应的离子方程式是
。
(2) ①③⑤三种元素的最高价氧化物对应的水化物中,碱性最强的化合物的化学式是
(3) ①②③三种元素的原子半径由大到小的顺序是 > > 。
(4) 某元素的最高价氧化物对应的水化物既能与酸反应生成盐和水,又能和碱反应
生成盐和水,该元素的最高价氧化物和盐酸反应的离子方程式为
。
向该元素和⑧号元素形成的化合物的溶液中,缓慢滴加氨水至过量,产生的实验现象是 ,有关反应的化学方程式为 。(5)⑥元素形成的单质与浓硝酸发生化学反应的化学方程式为
。
如下图所示: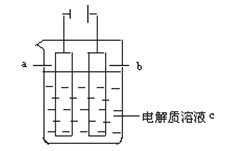
(1)a电极是_________(填“阴极”或“阳极”),b电极是_________(填“阴极”或“阳极”)。
(2)当电解NaCl溶液时:
①a电极的电极反应为________________,该反应是_______(填“氧化”或“还原”)反应;
②b电极的电极反应为______________,该反应是_________(填“氧化”或“还原”)反应。
(3)当电解精炼铜时:
①a电极是__________(填“粗铜”或“纯铜”),其电极反应为__________________________;
②b电极是__________(填“粗铜”或“纯铜”),其电极反应为__________________________。
用铜、锌和硫酸铜溶液设计一个原电池。
原电池的负极是 ,电极反应式是 ;
正极是 ,电极反应式是 。
(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+) c(CH3COO-)(填“ >” 或“=”或“<” )。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 ,溶液中c(Na+) c(CH3COO-)(填“ >” 或“=”或“<” )
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 ,醋酸体积 氢氧化钠溶液体积。(填“ >” 或“=”或“<” )
根据下列叙述写出相应的热化学方程式:
(1)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,该反应的热化学方程式是
_____________________________________。
(2)下图是SO2生成SO3反应过程中能量变化的曲线图。该反应的热化学方程式为: 。
某温度(T ℃)下的溶液中,c(H+)=10-x mol·L-1,c(OH-)=10-y mol·L-1,x与y的关系如图所示,请回答下列问题:
(1)此温度下,水的离子积Kw为________,则该温度T______25(填“>”、“<”或“=”)。
(2)在此温度下,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示。
| 实验序号 |
Ba(OH)2溶液的体积/mL |
盐酸的体积/mL |
溶液的pH |
| ① |
22.00 |
0.00 |
8 |
| ② |
22.00 |
18.00 |
7 |
| ③ |
22.00 |
22.00 |
6 |
假设溶液混合前后的体积变化忽略不计,则a=________,实验②中由水电离产生的c(OH-)=______mol·L-1。
(3)在此温度下,将0.1 mol·L-1的NaHSO4溶液与0.1 mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
| 甲 |
乙 |
丙 |
丁 |
|
| 0.1 mol·L-1 Ba(OH)2溶液体积/mL |
10 |
10 |
10 |
10 |
| 0.1 mol·L-1 NaHSO4溶液体积/mL |
5 |
10 |
15 |
20 |
①按丁方式混合后,所得溶液显________(填“酸”、“碱”或“中”)性。
②写出按乙方式混合后,反应的离子方程式:________________________。
③按甲方式混合后,所得溶液的pH为__________。