钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属。目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4:
2FeTiO3+7Cl2+6C 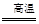 2TiCl4+2FeCl3+6CO
2TiCl4+2FeCl3+6CO
TiO2+2Cl2+2C 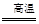 TiCl4+2CO
TiCl4+2CO
将TiCl4蒸馏并提纯,在氩气保护下与镁共热得到钛:TiCl4+2Mg 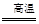 Ti+2MgCl2
Ti+2MgCl2
MgCl2和过量Mg用稀盐酸溶解后得海绵状钛,再在真空熔化铸成钛锭。
请回答下列问题:
(1)基态钛原子的价电子排布式为_________。
(2)与CO互为等电子体的离子为_______(填化学式)。
(3)在CH2Cl2、C6H6、CO2、C2H4中,碳原子采取sp杂化的分子有___________。
(4)TiCl4在常温下是无色液体,在水或潮湿空气中易水解而冒白烟。则TiCl4属于__________(填“原子”、“分子”或“离子”)晶体。
(5)与钛同周期的另一种元素钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,现象是_______;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为_________。
磷化硼(BP)和氮化硼(BN)是受到高度关注的耐磨涂料,它们的结构相似,右下图为磷化硼晶体结构中最小的重复结构单元。磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成:BBr3+PBr3+3H2=BP+6HBr。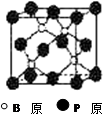
回答下列问题:
(1)上述反应物中含有一种元素,其基态原子具有八种不同能量电子,写出其基态原子的价电子轨道表示式 。
(2)BP中每个B或P原子均形成4个共价键,其中有一个配位键,提供空轨道是 原子。
(3)磷化硼的晶体类型是 ,B原子的杂化方式是 ,每生成1molBP,共形成 molB-P键。
(4)已知BBr3+PBr3+3H2=BP+6HBr反应中,P元素被还原,判断电负性:P B (填“>”、“<”)
(5)BBr3分子中,B原子采取 杂化,键角为
(6)氮化硼晶体的熔点要比磷化硼晶体高,其原因是
。
( 12分)有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请回答问题。
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2 =" 1451" kJ/mol I3 = 7733kJ/mol I4 = 10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第八列 |
(1)已知BA5为离子化合物,是由、两种微粒构成的(填化学符号)。
(2)B基态原子中能量最高的电子,其电子云在空间有个方向,原子轨道呈形。
(3)某同学根据上述信息,推断C基态原子的核外电子排布为,
该同学所画的电子排布图违背了。
(4)G位于族,G3+价电子排布式为。GE3常温下为固体,熔点 ,沸点
,沸点 ,在
,在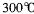 以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断GE3的晶体类型为________________。
以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断GE3的晶体类型为________________。
(5)DE3 中心原子的杂化方式为,其空间构型为。
(6)前四周期中与F同一族的所有元素分别与E元素形成化合物,其晶体的熔点由高到低的排列顺序为(写化学式),原因是
( 9分)A、B都是短周期元素,原子最外层电子排布式分别为(n+1)sx、nsx+1npx+3。A与B可形成化合物D。D溶于水时有气体逸出,该气体能使带火星的木条复燃。请回答下列问题:
(1)比较电离能:I1(A)________I1(B)(填“>”或“<”,下同),比较电负性:A________B。
(2)通常A元素的化合价是________,对A元素呈现这种价态进行解释:
①用原子结构的观点进行解释: _______________________________________。
②用电离能的观点进行解释: ___________________________________________。
③写出D跟水反应的离子方程式:_______________________________________。
( 8分, 多选错选不得分)现有下列物质, 用编号填空回答下列问题:
A.干冰B.金刚石C. 氦D.过氧化钠E.二氧化硅F. 溴化铵
(1)通过非极性键形成的原子晶体是:。
(2)可由原子直接构成的晶体是: 。
(3)含有离子键、共价键、配位键的化合物是:。
(4)含有非极性键的离子化合物是:。
(5) 已知微粒间的作用力包括离子键、共价键、金属键、范德华力、氢键。氯化钠熔化,粒子间克服的作用力为____________;二氧化硅熔化,粒子间克服的作用力为____________;干冰气化,粒子间克服的作用力为____________。A、B、C、D四种物质的熔点从低到高的顺序为____________________(填序号)。
蓄电池是一种可以反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应是:NiO2 + Fe + 2H2O Fe(OH)2 + Ni(OH)2。
Fe(OH)2 + Ni(OH)2。
(1)若此蓄电池放电时,该电池某一电极发生还原反应的物质是(填序号)。
| A.NiO2 | B.Fe | C.Fe(OH)2 | D.Ni(OH)2 |
(2)该电池放电时,正极附近溶液的PH(填增大、减小、不变)
(3)充电时该电池阳极的电极反应式
(4)用此蓄电池分别电解以下两种溶液,假如电路中转移了0.02 mole-,且电解池的电极均为惰性电极,试回答下列问题。
①电解M(NO3)x溶液时某一电极增加了 g M,则金属M的相对原子质量为(用含“
g M,则金属M的相对原子质量为(用含“ 、x”的表达式表示)。
、x”的表达式表示)。
②电解含有0.01 mol CuSO4和0.01 mol NaCl的混合溶液100mL,阳极产生的气体在标准状况下的体积是;将电解后的溶液加水稀释至1L,此时溶液的PH=。