下表是某地区市场上销售的一种“加碘食盐”包装袋上的部分文字说明。请根据此表,结合初中化学和生物学科的知识,回答下列问题。
| 配料表 |
精制海盐、碘酸钾 |
| 含碘量 |
20~40mg/kg |
| 卫生许可证号 |
××卫碘字(1999)第001号 |
| 分装日期 |
见封底 |
| 储藏方法 |
密封、避光、防潮 |
| 食用方法 |
烹调时,待食品熟后加入碘盐 |
⑴ 要在食盐中加碘,是因为碘是人体内合成 激素的主要原料,缺碘会引起疾病。
⑵ 食盐中加碘,这碘指的是 (填“元素”、“ 原子”或“单质”)。
⑶ 碘酸钾的化学式为KIO3,其中碘元素的化合价为 。
⑷ 根据含碘盐的食用方法可推测碘元素的化学性质,碘酸钾在受热时容易 。
煤化工中常需研究不同温度下平衡常数、投料比及热值等问题
已知:CO(g)+H2O(g) H2(g)+CO2(g)的平衡常数随温度变化如下表:
H2(g)+CO2(g)的平衡常数随温度变化如下表:
| 温度/℃ |
400 |
500 |
800 |
| 平衡常数Kc |
9.94 |
9 |
1 |
试回答下列问题
(1)上述逆反应是: 反应(选填:“放热”、“吸热”)。
(2)在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有 (选填A、B、C、D、E)。
| A |
B |
C |
D |
E |
|
| n(CO2) |
3 |
1 |
0 |
1 |
1 |
| n(H2) |
2 |
1 |
0 |
1 |
2 |
| n(CO) |
1 |
2 |
3 |
0.5 |
3 |
| n(H2O) |
5 |
2 |
3 |
2 |
1 |
(3)已知在一定温度下:C(s)+CO2(g)  2CO(g)平衡常数K;
2CO(g)平衡常数K;
C(s) + H2O(g)  CO(g)+H2(g)平衡常数K1;
CO(g)+H2(g)平衡常数K1;
CO(g)+H2O(g) H2(g)+CO2(g) 平衡常数K2 。
H2(g)+CO2(g) 平衡常数K2 。
则K、K1、K2之间的关系是: 
(4)在VL密闭容器中通入10molCO和10mol水蒸气,在T℃达到平衡,然后急速除去水蒸气(除水蒸气时各物质的物质的量不变),将混合气体燃烧,测得放出的热量为2842kJ(已知CO燃烧热为283kJ/mol,H2燃烧热为286kJ/mol),则T℃平衡常数K= 。
降低大气中CO2的含量及有效利用CO2,目前已引起各国普遍重视。
(1)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH--4e-=O2↑+2H2O,则阴极反应式为。
(2)工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,在500℃下发生反应:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g) 。
CH3OH(g)+H2O(g) 。
实验测得CO2(g)和CH3OH(g)的浓度随时间变化如下图1所示。
①图2是改变温度时H2的化学反应速率随时间变化的示意图,则该反应的正反应
是(填“吸热”或“放热”)反应。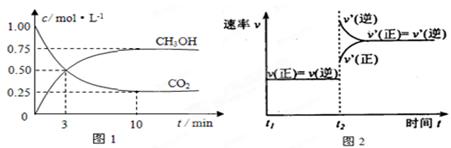
②500℃达平衡时,CH3OH的体积分数为。
(1)将反应2H2(g)+O2(g)=2H2O(1) △H<0,以KOH溶液为电解质溶液,设计一个原电池,其负极反应为:。
(2)电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与下图中电解池相连,其中,a为电解液,X和Y是两块电极板,则: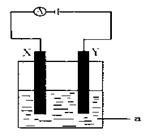
①若X和Y均为惰性电极,a为CuSO4溶液,则电解时的化学反应方程式为:。
通过一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为。
②若X、Y分别为铁和铜,a仍为CuSO4溶液,则Y极的电极反应式为。
一定温度下,在一个10L密闭容器中只投反应物发生某可逆反应,其平衡常数表达式为K=  ,请回答下列问题:
,请回答下列问题:
(1)该反应的化学方程式为___________________________________;若温度升高,K增大,则该反应是____反应(填“吸热”或“放热”)。
(2)能判断该反应一定达到平衡状态的是__________(填字母序号)。
| A.υ正(H2O)=υ逆(H2) |
| B.容器中气体的平均相对分子质量不随时间改变 |
| C.消耗nmolH2的同时消耗nmolCO |
| D.容器中物质的总物质的量不随时间改变 |
(3)该反应的υ正随时间变化的关系如图,在t2时改变了某种条件,改变的条件可能是_________________________、________________________。
某兴趣小组利用如图所示装置进行实验。
(1)断开K2、闭合K1,U形管内除电极上有气泡外,还可观察到的现象是;阳极电极反应式为。当电路中转移0.001mol电子时,右侧注射器最多可以收集到气体mL
(折算为标准状况)。
(2)断开K2、闭合K1一段时间,待注射器中充有一定量的气体后,断开K1、闭合K2,此时装置内化学能转化为电能。实现能量转化的化学方程式为;
(3)假设实验装置不漏气,当(2)中注射器内气体全部参加反应后,U形管内的溶液理论上(填“能”或“不能”)恢复原样。