工业上用铝土矿(主要成分为Al2O3、Fe2O3、SiO2)提取氧化铝做冶炼铝的原料,提取的操作过程如下:
(1)第一步在铝土矿中加入盐酸后的实验基本操作是 ,若在固体B中加入氢氧化 钠溶液 (填”会”或”不会”)发生反应,若会,则写出反应的离子方程式
钠溶液 (填”会”或”不会”)发生反应,若会,则写出反应的离子方程式
(2)验证滤液A中是否含Fe3+,可取少量滤液A并加入 (填试剂名称),现象是 。
(3)写出碳酸氢钠的一种用途 。
选做【化学——物质的结构】在元素周期表中,除稀有气体外几乎所有元素都能与氢形成氢化物。氢化物晶体的结构有共价型和离子型之分。
(1)氨气是共价型氢化物。工业常用氨气和醋酸二氨合铜{[Cu(NH3)2]Ac}的混合液来吸收一氧化碳(醋酸根CH3COO-简写为Ac-)。反应方程式为:[Cu(NH3)2]Ac+ CO+NH3 [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac
①请写出基态Cu原子的电子排布式。
②氨水溶液中各元素原子的电负性从大到小排列顺序为。
③醋酸分子中的两个碳原子,甲基(—CH3)碳和羧基(—COOH)碳的杂化方式分别是。
④生成物[Cu(NH3)3CO]Ac中所含化学键类型有。
a.离子键b.配位键c.σ键d.π键
(2)某离子型氢化物化学式为XY2,晶胞结构如下图所示,其中6个Y原子(○)用阿拉伯数字1~6标注。
①已知1、2、3、4号Y原子在晶胞上、下面上。则5、6号Y原子均在晶胞。(填“侧面”或“内部”)
②XY2晶体、硅烷晶体和固态氨3种氢化物熔沸点高低顺序正确的是。
a.XY2晶体>硅烷晶体>固态氨b.XY2晶体>固态氨>硅烷晶体
c.固态氨>硅烷晶体>XY2晶体d.硅烷晶体>固态氨>XY2晶体
选做【化学——化学与技术】煤炭被人们誉为黑色的“金子”,它是人类使用的主要能源之一。为了提高煤的利用率,减少有害气体的排放,人们采取了各式各样的方法。
(1)煤的气化和液化可以提高煤的利用率。煤的气化技术的主要产物是。煤的液化技术又分为直接液化和间接氧化。将煤隔绝空气加强热得到焦炉气、煤焦油及焦炭等产品的技术称为。
(2)煤在燃烧前、后及燃烧过程中均可采取措施减少有害气体的排放。
①在燃烧前,可以采用微生物脱硫技术。原理如下:
上述过程中Fe2+的作用为。写出Fe2+ Fe3+的离子方程式。
Fe3+的离子方程式。
②煤在燃烧时,进行脱硫处理,常采用燃烧技术,在把煤和脱硫剂加入锅炉燃烧室,使煤与空气在流化过程中充分混合、燃烧,起到固硫作用。常用脱硫剂的主要化学成分为(填化学式)。
③煤在燃烧后,烟气净化常采用除尘技术和脱硫、脱硝技术。湿法脱硫、脱硝技术中将烟气通入设备,用石灰水淋洗。
工业常用燃料与水蒸气反应制备H2和CO, 再用H2和CO合成甲醇。
(1)制取H2和CO通常采用:C(s)+H2O(g)  CO(g)+H2(g) △H=+131.4 kJ·mol-1,下列判断正确的是。
CO(g)+H2(g) △H=+131.4 kJ·mol-1,下列判断正确的是。
a.该反应的反应物总能量小于生成物总能量
b.标准状况下,上述反应生成1L H2气体时吸收131.4 kJ的热量
c.若CO(g)+H2(g) C(s)+H2O(1) △H=-QkJ·mol-1,则Q<131.4
C(s)+H2O(1) △H=-QkJ·mol-1,则Q<131.4
d.若C(s)+CO2(g) 2CO(g) △H1;CO(g)+H2O(g)
2CO(g) △H1;CO(g)+H2O(g) H2(g)+CO2(g) △H2则:△H1+△H2=+131.4 kJ·mol-1
H2(g)+CO2(g) △H2则:△H1+△H2=+131.4 kJ·mol-1
(2)甲烷与水蒸气反应也可以生成H2和CO,该反应为:CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
已知在某温度下2L的密闭绝热容器中充入2.00mol甲烷和1.00mol水蒸气,测得的数据如下表:
| 不同时间各物质的物质的量/mol |
||||
| 0 min |
2min |
4min |
6min |
|
| CH4 |
2.00 |
1.76 |
1.60 |
n2 |
| H2 |
0.00 |
0.72 |
n1 |
1.20 |
根据表中数据计算:
①0 min~2min内H2的平均反应速率为。
②达平衡时,CH4的转化率为。在上述平衡体系中再充入2.00mol甲烷和1.00mol水蒸气,达到新平衡时H2的体积分数与原平衡相比(填“变大”、“变小”或“不变”),可判断该反应达到新平衡状态的标志有______。(填字母)
a.CO的含量保持不变
b.容器中c(CH4)与c(CO)相等
c.容器中混合气体的密度保持不变
d.3ν正(CH4)=ν逆(H2)
(3)合成甲醇工厂的酸性废水中含有甲醇(CH3OH),常用向废液中加入硫酸钴,再用微生物电池电解,电解时Co2+被氧化成Co3+,Co3+把水中的甲醇氧化成CO2,达到除去甲醇的目的。工作原理如下图(c为隔膜,甲醇不能通过,其它离子和水可以自由通过)。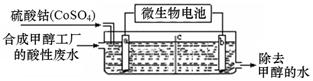
①a电极的名称为。
②写出除去甲醇的离子方程式。
③微生物电池是绿色酸性燃料电池,写出该电池正极的电极反应式为。
【化学——选修3:物质结构与性质】X、Y、Z、L四种元素分别位于周期表中三个紧相邻的周期且原子序数依次增大,它们相关信息如下:
X元素原子的价电子构型为nsnnp2n
Y和Z位于同一周期,最外层都有两个未成对电子
L元素原子的基态未成对电子数是同周期最多的元素。
请回答如下问题:
(1)L元素在周期表中的位置是。
该原子核外电子排布式是。
其最高正价氧化物对应的水化物的化学式是和。
(2)元素X与Y形成的化合物晶体类型是晶体
1mol该化合物含有的化学键数为(用阿伏加德罗常数NA表示)
(3)元素M是周期表中电负性最强的元素,X与M形成的化合物XM2的分子几何构型是,该化合物中X原子的杂化轨道类型是。
(4)X与碳、氢三种元素形成的相对分子质量最小的分子里有个δ键,个л键
(5)金属元素N与Z形成的离子化合物的晶胞结构如图,晶胞中Z离子数目为。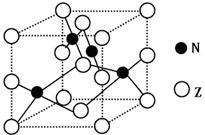
【化学——选修2:化学与技术】海洋是一个丰富的资源宝库,通过海水的综合利用可获得许多物质供人类使用。
(1)海水中盐的开发利用:
①海水制盐目前以盐田法为主,建盐田必须选在远离江河入海口,多风少雨,潮汐落差大且又平坦空旷的海滩。所建盐田分为贮水池、池和结晶池。
②工业上通常以NaCl、CO2和NH3为原料制取纯碱,请写出第一步制取NaHCO3的化学方程式:。
(2)电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示。其中具有选择性的阴离子交换膜和阳离子交换膜相间排列。请回答下面的问题: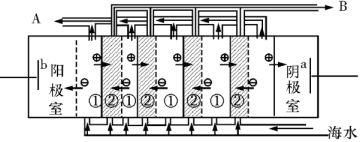
ⅰ电渗析法淡化海水中阴极室可获得的重要化工原料有。
ⅱ上图中虚线部分表示离子交换膜。淡水从(A或B)排出。
(3)用苦卤(含Na+、K+、Mg2+、Cl-、Br-等离子)可提取溴,其生产流程如下: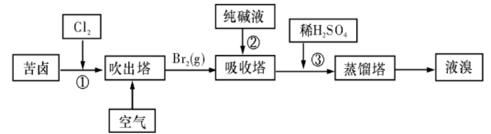
ⅰ.写出反应③的离子方程式为:。
ⅱ.通过①氯化已获得含Br2的溶液,为何还需经过吹出、吸收、酸化来重新获得含Br2的溶液?。
ⅲ.向蒸馏塔中通入水蒸气加热,控制温度在90℃左右进行蒸馏的原因是。。