有一瓶澄清的溶液,其中可能含有NH4+、K+、Mg2+、Ba2+、Al3+、Fe3+、I-、NO3-、CO32-、SO42-中的几种。取该溶液进行以下实验:
①用pH试纸检验,表明溶液呈强酸性。
②取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡CCl4层呈紫红色。
③另取部分溶液,逐渐向其中加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,均无沉淀产生。
④另取部分上述碱性溶液,向其中加入Na2CO3溶液,有白色沉淀生成。
⑤将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实确定:
(1)写出⑤所发生反应的离子方程式 ▲
(2)该溶液中肯定存在的阳离子是 ▲
(3)该溶液中肯定不存在的阴离子是 ▲
氨基甲酸铵(H2NCOONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组用如下方法制备氨基甲酸铵,反应的化学方程式如下:
2NH3(g)+CO2(g) H2NCOONH4(s) ΔH<0
H2NCOONH4(s) ΔH<0
(1)实验室通常采用图1装置制取氨气,你所选择的试剂是。
(2)制备氨基甲酸铵的装置如图2所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是。
液体石蜡鼓泡瓶的作用是。
②从反应后的混合物中分离出产品的实验方法(填操作名称)。为了得到干燥产品,应采取的方法是________(填写选项序号)。
a.常压加热烘干b.高压加热烘干c.真空40 ℃以下烘干
③尾气处理装置如图3所示。能否将浓H2SO4改为稀H2SO4(填“能”或“否”),理由是。
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品1.570 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为2.000 g。则样品中氨基甲酸铵的质量分数为_______。
[Mr(NH2COONH4)=78、Mr(NH4HCO3) =79、Mr(CaCO3)=100]
研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)已知拆开1 mol H2、1 mol O2和液态水中1 mol O—H键使之成为气态原子所需的能量分别为436 kJ、496 kJ和462 kJ;CH3OH(g)的燃烧热为627 kJ·mol-1。则CO2(g)+3H2(g)=CH3OH(g)+H2O(l)∆H=kJ·mol-1。
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(l)
CH3OCH3(g)+3H2O(l)
①该反应平衡常数表达式K=。
②已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如图所示。该反应的∆H0(填“>”或“<”)。若温度不变,减小反应投料比[n(H2)/n(CO2)],则K将(填“增大”、“减小”或“不变”)。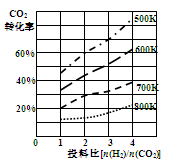
③某温度下,向体积一定的密闭容器中通入CO2(g)与H2(g)发生上述反应,当下列物理量不再发生变化时,能表明上述可逆反应达到化学平衡的是。
| A.二氧化碳的浓度 | B.容器中的压强 |
| C.气体的密度 | D.CH3OCH3与H2O的物质的量之比 |
(3)向澄清的石灰水中通入CO2至溶液中的Ca2+刚好完全沉淀时,则溶液中c(CO32-)=。[已知:Ksp(CaCO3)=2.8×10-9]
海洋资源的开发与利用具有广阔的前景。海水的pH一般在7.5~8.6之间。某地海水中主要离子的含量如下表:
| 成分 |
Na+ |
K+ |
Ca2+ |
Mg2+ |
Cl- |
SO42- |
HCO3- |
| 含量/mg∙L-1 |
9360 |
83 |
160 |
1100 |
16000 |
1200 |
118 |
(1)海水显弱碱性的原因是(用离子方程式表示):,该海水中Ca2+的物质的量浓度为__________mol/L 。
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如下图所示。其中阴(阳)离子交换膜只允许阴(阳)离子通过,电极均为惰性电极。
① 开始时阳极的电极反应式为。
② 电解一段时间,极(填“阴”或“阳”)会产生水垢,其成份为(填化学式)。
③ 淡水的出口为a、b、c中的__________出口。
(3)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如图所示:
该电池电解质为能传导 Li+的固体材料。
上面左图中的小黑点表示(填粒子符号),充电时该电极反应式为。
(4)利用海洋资源可获得MnO2 。MnO2可用来制备高锰酸钾:将MnO2与KOH混合后在空气中加热熔融,得到绿色的锰酸钾(K2MnO4),再利用氯气将锰酸钾氧化成高锰酸钾。该制备过程中消耗相同条件下氯气和空气的体积比为(空气中氧气的体积分数按20%计)。
硅酸钠被国家列为“我国优先发展的精细化学品”和“今后我国无机化工产品发展重点”之一。下图是用海边的石英砂(含氯化钠、氧化铁等杂质)制备硅酸钠的工艺流程示意简图:
(1)要将洗出液中的溶质析出,采用的方法是(填:“蒸发”、“降温”)结晶;蒸发时用到的硅酸盐仪器有、、。
(2)上流程中加入NaOH溶液,反应的离子方程式为。
(3)用上述残渣中的氧化铁焊接铁轨,其铝热反应的化学方程式为(并在方程式中用“单线桥”标出电子转移方向和数目)。
小王同学在一次实验中发现:把新制氯水逐滴加到含有酚酞的氢氧化钠溶液中,
当加到最后一滴时溶液的红色突然消失。
知识储备:将氯气通入水中的化学方程式为;
氯水中具有强氧化性的分子有、。
探究“溶液的红色突然消失”的原因:
①猜想:a.是氯水中的盐酸中和了NaOH,使酚酞由红色变成无色;
b.是。
②设计实验:往已褪色的溶液中连续滴加NaOH溶液至过量,若现象为,则证明“猜想a”正确;若现象为,则“猜想b”正确。