某小组学生想研究不同物质对双氧水分解速率的影响,以生成气体量50mL为标准,设计了如下实验方案:
| 实验序号 |
双氧水体积 |
双氧水浓度 |
添加的物质 |
待测数据X |
| 1 |
100mL |
20% |
无 |
|
| 2 |
100mL |
20% |
10gMnO2 |
|
| 3 |
100mL |
20% |
10gKI |
|
| 4 |
100mL |
20% |
新鲜猪肝 |
|
(1)在该研究方案中,MnO2、KI和猪肝在双氧水分解的过程中可能起到 的作用。
(2)待测数据X为 。
(3)以下措施可以加快该实验中双氧水分解速率的是: (填标号)。
A.将双氧水的体积增大至200mL
B.将双氧水的浓度增大至30%
C.对装置A加热
D.上下移动B装置使量气管内气体压强增大
(4)从控制变量的原理来看,该方案是否合理 (填“是”或“否”)。理由是:
已知:A、B、C、D、E、F六种元素核电荷数依次增大,属周期表中前四周期的元素。其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中最高;F能形成红色(或砖红色)的F2O和黑色的FO两种氧化物。
回答下列问题:
(1)F的原子的M层电子排布式为。
(2)B、C、D的第一电离能由小到大的顺序为。(用元素符号表示)
(3)A的简单氢化物分子极易溶于水,其主要原因是.
(4)E的最高价氧化物分子的空间构型是。其中心原子的杂化方式为。
(5)F的高价离子与A的简单氢化物形成的配离子,配位数为。
(6)A、F形成某种化合物的晶胞结构如图所示,则其化学式为;(黑色球表示F原子),已知紧邻的白球与黑球之间的距离为a cm, 该晶胞的密度为g/cm3。
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
已知:① 2KOH + Cl2 =" KCl" + KClO + H2O(条件:温度较低)
② 6KOH + 3Cl2 =" 5KCl" + KClO3 + 3H2O(条件:温度较高)
③ 2Fe(NO3)3 + 2KClO + 10KOH = 2K2FeO4 + 6KNO3 + 3KCl + 5H2O
回答下列问题:
(1)该生产工艺应在(填“温度较高”或“温度较低”)的情况下进行;
(2)写出工业上制取Cl2的化学方程式;
(3)K2FeO4可作为新型多功能水处理剂的原因;
(4)与MnO2 -Zn电池类似,K2FeO4 -Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为________,该电池总反应的离子方程式为_____。
(5)在“反应液I ”中加KOH固体的目的是①,②;
(6)从“反应液II ”中分离出K2FeO4后,副产品是(写化学式)。
2013年12月2日,我国在西昌卫星发射中心用“长征三号甲”运载火箭将“嫦娥三号”探月卫星成功送入太空,进一步向广寒宫探索。“长征三号甲”是三级液体助推火箭,一、二级为常规燃料,常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂。
Ⅰ.常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂。但有人认为若用氟气代替二氧化氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。
已知:N2H4(g)+O2(g)=N2(g)+2H2O(g)△H = -543kJ·mol-1 H2(g)+
H2(g)+  F2(g) = HF(g)△H = -269kJ·mol-1
F2(g) = HF(g)△H = -269kJ·mol-1
H2(g)+  O2(g) = H2O(g)△H = -242kJ·mol-1
O2(g) = H2O(g)△H = -242kJ·mol-1
请写出肼和氟气反应的热化学方程式:_____________________________。
Ⅱ.氧化剂二氧化氮可由NO和 O2生成,已知在2 L密闭容器内,800 ℃时反应:
2NO(g)+O2(g) 2NO2(g) ΔH的体系中,n(NO)随时间的变化如表:
2NO2(g) ΔH的体系中,n(NO)随时间的变化如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.200 |
0.100 |
0.080 |
0.050 |
0.050 |
0.050 |
| n(O2)(mol) |
0.100 |
0.050 |
0.040 |
0.025 |
0.025 |
0.025 |
(1) 已知:K800℃>K1000℃,则该反应的ΔH ______0(填“大于”或“小于”),用O2表示从0~2 s内该反应的平均速率为__________。
(2)能说明该反应已达到平衡状态的是________。
a.容器内颜色保持不变 b. 2v逆(NO)=v正(O2)
c.容器内压强保持不变 d.容器内密度保持不变
(3)为使该反应的速率增大,提高NO的转化率,且平衡向正反应方向移动应采取的措施有。
(4)在上述条件下,计算通入2 mol NO和1 mol O2的平衡常数K=______________。
(5)在上述条件下,若开始通入的是0.2 mol NO2气体,达到化学平衡时,则NO2的转化率为。
铜及其化合物在生产、生活中有广泛的应用。
Ⅰ、铜可采用如下方法制备:
方法一:火法炼铜:Cu2S + O2 2Cu + SO2
2Cu + SO2
方法二:湿法炼铜: CuSO4+ Fe FeSO4+ Cu
上述两种方法中,你认为哪种方法更好,原因是(写出1条原因即可)。分别用火法炼铜与湿法炼铜生产640gCu,则转移的电子数之比为。
Ⅱ、印刷电路板上使用的铜需要回收利用。
用FeCl3溶液浸泡印刷电路板制备CuCl2·2H2O晶体,实验室模拟回收过程如下:
①步骤2中反应的离子方程式是。
②步骤5中蒸发浓缩CuCl2溶液时,要滴加浓盐酸,目的是________________ (用化学方程式并结合简要的文字说明),再经冷却、结晶、过滤,得到CuCl2·2H2O晶体。
③步骤4中洗涤沉淀的操作为
④步骤3中可选用的“试剂1”是(写出一种即可),目的是使溶液的pH升高到4,此时Fe3+浓度为[Ksp(Fe(OH)3)=4×10-38]。
已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G为黄绿色;形成D的元素原子的最外层电子数是次外层的3倍;B的焰色反应呈紫色(透过蓝色钴玻璃);K为红棕色粉末。其转化关系如图。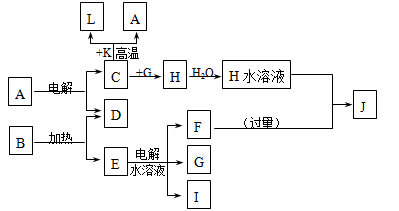
请回答:
(1)工业上制C用A不用H的原因
(2)写出C与K反应的化学方程式,该反应的反应物总能量(填“大于”或“小于”)生成物总能量
(3)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,接通电源(短时间)电解E水溶液的化学方程式。
(4)J与H反应的离子方程式为。