(9分)盐酸常用于清除金属表面的铜锈铁锈。某同学欲将除锈后的盐酸中的金属元素分步沉淀,查资料获知常温下水溶液中各离子沉淀的pH范围:
| 离子 |
开始沉淀的pH |
沉淀完全的pH |
| Fe3+ |
1. 0 |
3. 0 |
| Fe2+ |
5. 8 |
8. 8 |
| Cu2+ |
4.2 |
6.7 |
(1)若以离子浓度降至1×10-5 mol·L-1为沉淀完全,根据上表数据推算出ksp[Fe(OH)3]=
(2)根据上述数据该同学设计了以下实验流程:
A可能是 ;试剂B的化学式是 ;沉淀②化学式是 。
某温度时,在VL密闭容器中,A、B、C三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析: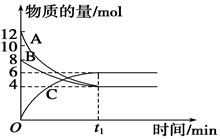
(1)反应的化学方程式为__________________。
(2)从开始到t1 min末时,用物质C表示的反应速率为____________________。
反应3Fe(s)+4H2O====Fe3O4(s)+4H2(g),在一可变容积的密闭容器中进行,试回答:
(1)增加Fe的量,其正反应速率 (填变快、不变、变慢,以下相同)。
(2)将容器的体积缩小一半,其正反应速率 ,逆反应速率 。
(3)保持体积不变,充入N2使体系压强增大,其正反应速率 ,逆反应速率 。
(4)保持压强不变,充入N2使容器的体积增大,其正反应速率 ,逆反应速率 。
写出下列反应的热化学方程式。
(1)在1.01×105Pa时,4g氢气在O2中完全燃烧生成液态水,放出572KJ的热量,则H2的燃烧热的热化学方程式为 。
(2)3 molNO2气体溶于水生成HNO3和NO气体,放出138kJ热量 。
(3)实验测得25℃、101kPa时1molC完全燃烧放出393.5 kJ的热量,写出C燃烧的热化学方程式:
。
(4)实验测得25℃、101kPa时1molH2完全燃烧放出285.8 kJ的热量,写出H2燃烧的热化学方程式: 。
将铁粉、铜粉、FeCl3溶液、FeCl2溶液和CuCl2溶液混合于某容器中充分反应(容器不参与反应),试判断下列情况溶液中存在的金属离子和金属单质。
(1)若铁粉有剩余,则容器中不可能有______________________________。
(2)若CuCl2有剩余,则容器中一定有_______________可能有_______________。
(3)若FeCl3和CuCl2都有剩余,则容器中不可能有_____________,一定有_____________。
(1)氯气是最早用于饮用水消毒的物质,其消毒作用主要是氯气溶于水后生成了次氯酸,该反应的离子方程式为___________________
(2)写出工业上制取漂白粉的化学反应方程式:_________________
(3)写出氯气实验室制法方程式:_____________________
(4)ClO2被称为“第四代”饮用水消毒剂,因其高效率、无污染而被广泛使用。北京永利科技有限公司已用电解法批量生产ClO2。其反应原理为4ClO-+4H+ 4ClO2↑+O2↑+2H2O,相同物质的量的氯气与二氧化氯消毒时转移电子数目之比是______________
4ClO2↑+O2↑+2H2O,相同物质的量的氯气与二氧化氯消毒时转移电子数目之比是______________