将SO2 气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:SO2+2Fe3++2H2O===SO
气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:SO2+2Fe3++2H2O===SO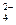 +4H++2Fe2+,
+4H++2Fe2+,
Cr2O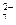 +6Fe2++14H+===2Cr3++6Fe3++7H2O。
+6Fe2++14H+===2Cr3++6Fe3++7H2O。
下列说法正确的是( )
| A.还原性:Cr3+>Fe2+>SO2 | B.氧化性:Cr2O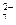 >SO2>Fe3+ >SO2>Fe3+ |
C.Cr2O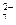 能将Na2SO3氧化成Na2SO4 能将Na2SO3氧化成Na2SO4 |
D.两个反应中Fe2(SO4)3均作还原剂 |
反应:2H2(g)+O2(g)===2H2O(l)过程中的能量变化如图所示,下列有关说法中正确的是()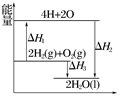
| A.ΔH1<0 | B.ΔH2为该反应的反应热 |
| C.ΔH3不是H2的燃烧热 | D.ΔH2=ΔH1+ΔH3 |
25℃时,下列叙述中,正确的是()
| A.CH3COONa溶液中:c(Na+) = c(CH3COO-) |
| B.pH=3的醋酸溶液加水稀释过程中:溶液中各离子浓度均变小 |
| C.pH相同的NaOH溶液与NaHCO3溶液中:水的电离程度相同 |
| D.pH=9的NaHX溶液中: c(H2X)>c(X2-) |
下图是用未知浓度的NaOH溶液来滴定10mL盐酸(标准液)所得的曲线(25℃),则下列说法不正确的是()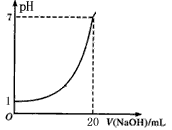
| A.标准液盐酸的浓度为0.1 mol/L |
| B.NaOH溶液的浓度为0.05 mol/L |
| C.滴定终点时,俯视碱式滴定管读数,所测NaOH溶液浓度会偏高 |
| D.指示剂变色时,说明盐酸与NaOH恰好完全反应 |
在密闭容器中,一定量混合气体发生下列反应: aM(g)+bN(g)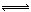 cW(g),达到平衡后,测得M气体的浓度为0.5mol/L。恒温下,将密闭容器的体积扩大1倍,再达平衡时,测得M气体的浓度为0.3mol/L。则下列叙述正确的是()
cW(g),达到平衡后,测得M气体的浓度为0.5mol/L。恒温下,将密闭容器的体积扩大1倍,再达平衡时,测得M气体的浓度为0.3mol/L。则下列叙述正确的是()
| A.反应速率增大 | B.平衡向正反应方向移动 |
| C.N的转化率提高 | D.W的体积分数降低 |
25℃时,下列说法不正确的是()
| A.NaHCO3溶液和Na2CO3溶液中含有的粒子种类完全相同 |
| B.用一定浓度的NaOH溶液滴定氢氟酸,当pH=6时,溶液中c(F-)-c(Na+)=9.9×10-7mol/L |
| C.中和同浓度同体积的盐酸和醋酸,消耗的NaOH的物质的量不相同 |
| D.用0.2 mol/L NaOH溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均为0.1 mol/L),至中性时,溶液中的酸未被完全中和 |