可逆反应:2NO2(g) 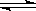 2NO(g) + O2(g),在体积不变的密闭容器中反应,达到平衡状态的标志是( )
2NO(g) + O2(g),在体积不变的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2 n mol NO2
②单位时间内生成n mol O2的同时生成2 n mol NO
③用NO2、NO、O2表示的反应速率数值之比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
| A.①④ | B.②③ | C.①③④ | D.①②③④ |
下列有关原子结构和元素周期律的表述正确的是
| A.原子序数为15的元素最高化合价为+5 |
| B.同周期元素中,VIIA族元素是非金属性最强的元素 |
| C.氧原子半径比氟原子半径大 |
| D.原子序数为12的元素位于元素周期表的第三周期IIA族 |
下列关于100mL 1mol·L-1 Na2CO3溶液的说法正确的是
| A.溶质N a2CO3质量为10.6g | B.用100mL 的容量瓶配制 |
| C.N a2CO3的摩尔质量为106g·mol-1 | D.量取水的体积小于100mL |
下列酸中,属于强酸的是
| A.硝酸 | B.盐酸 | C.硫酸 | D.高氯酸(分子式为HClO4) |
可用浓硫酸进行干燥的气体有
| A.SO2 | B.NH3 | C.HCl | D.CO2 |
下列有机物中,属于糖类的是
| A.葡萄糖 | B.蔗糖 | C.淀粉 | D.纤维素 |