(8分)某有机物的结构简式为HO-CH2—CH=CH—CH=CH-CHO。
(1)请你写出下列官能团
“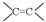 ”、“HO-”、“-CHO”的名称: 、 、 。
”、“HO-”、“-CHO”的名称: 、 、 。
(2)验证该有机物中含有“-CHO”,常采用的试剂是 ,产生的现象为 。
(3)该有机物的性质描述正确的有
| A.与金属Na反应放出O2 | B.能与新制Cu(OH)2反应,产生红色沉淀 |
| C.不能发生银镜反应 | D.一定条件下能与H2发生加成反应 |
(4)1mol该有机物完全与溴水发生加成反应时,需要Br2 mol
某同学想把AlCl3溶液和Na2S溶液混合制取Al2S3,但最后得到一种白色絮状沉淀,并且混合液中有臭鸡蛋气味的气体放出。试解释造成此结果的原因,写出反应的离子方程式,并指出制取硫化铝的正确方法。
(1)在饱和氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,同时还产生的现象有
①____________________________________________________________________________;
②____________________________________________________________________________。
用离子方程式表示产生上述现象的原因___________________________________________
____________________________________________________________________________。
(2)在饱和氯化铁溶液中加入一种单质,也会产生类似上述现象的反应,这种单质是________。
| A.磷 | B.硫 | C.镁 | D.铜 |
(3)向物质的量之和为0.1mol的FeCl3、AlCl3的混合溶液中加入90mL4mol·L-1的NaOH溶液,使其充分反应。假设原溶液中Al3+物质的量与Fe3+和Al3+总物质的量之比为x。
①当x=0.4时,溶液中产生的沉淀是_____________,其物质的量为_____________。
②当沉淀只有Fe(OH)3时,x的取值范围为_____________。
在纯碱溶液中滴入酚酞,溶液变红。若在该溶液中再滴入过量的氯化钡溶液,观察到的现象是:_____________________。其原因是(以离子方程式和简要文字说明):__________。
(1)现有0.1mol·L-1的纯碱溶液,试用pH试纸测定溶液的pH,正确的操作是__________。纯碱溶液呈碱性的原因(用离子方程式表式)是__________,你认为该溶液pH的范围一定介于__________之间。
(2)为探究纯碱溶液呈碱性是由 引起的,请设计一个简单的实验方案。
引起的,请设计一个简单的实验方案。
某温度下0.1mol·L-1Na2CO3溶液中,c(Na+)/c( )=20/9>2,其原因是(用离子方程式表示,下同)_________。现向Na2CO3溶液中通入一定量的CO2后,c(Na+)/c(
)=20/9>2,其原因是(用离子方程式表示,下同)_________。现向Na2CO3溶液中通入一定量的CO2后,c(Na+)/c( )=5/2>20/9,其原因是_________,此时c(
)=5/2>20/9,其原因是_________,此时c( )=_________。
)=_________。