已知:①R—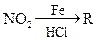 —
—
②苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。
以下是用苯作原料制备一系列化合物的转化关系图: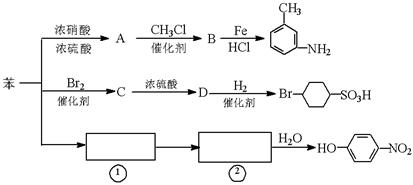
(1)A转化为B的化学方程式是_______________________________________。
(2)图中“苯→①→②”省略了反应条件,请写出①、②物质的结构简式:
①________________________,②____________________________。
(3)B在苯环上的二氯代物有 种同分异构体。
(4)有机物 的所有原子 (填“是”或“不是”)在同一平面上。
的所有原子 (填“是”或“不是”)在同一平面上。
软锰矿(主要成分为MnO2)可用于制备锰及其化合物。
(1)早期冶炼金属锰的一种方法是先煅烧软锰矿生成Mn3O4,再利用铝热反应原理制得锰,该铝热反应的化学方程式为 。
(2)现代冶炼金属锰的一种工艺流程如下图所示:
下表为t℃时,有关物质的pKsp(注:pKsp =-lgKsp)。
| 物质 |
Fe(OH)3 |
Cu(OH)2 |
Ca(OH)2 |
Mn(OH)2 |
CuS |
CaS |
MnS |
MnCO3 |
| pKsp |
37.4 |
19.32 |
5.26 |
12.7 |
35.2 |
5.86 |
12.6 |
10.7 |
软锰矿还原浸出的反应为:12MnO2 + C6H12O6 + 12H2SO4=12MnSO4 + CO2↑+18H2O
①该反应中,还原剂为__________。写出一种能提高还原浸出速率的措施: 。
②滤液1的pH (填“>”、“<”或“=”)MnSO4浸出液的pH。
③加入MnF2的主要目的是除去 (填Ca2+、Fe3+或Cu2+)
(3)由MnSO4制取MnCO3
往MnSO4溶液中加入过量NH4HCO3溶液,,该反应的离子方程式为_____________________;若往MnSO4溶液中加入(NH4)2CO3溶液,还会产生Mn(OH)2,可能的原因有:MnCO3(s) + 2OH-(aq) Mn(OH)2(s) + CO32-(aq),t℃时,计算该反应的平衡常数K= (填数值)。
Mn(OH)2(s) + CO32-(aq),t℃时,计算该反应的平衡常数K= (填数值)。
为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物含量显得尤为重要。
Ⅰ.氮氧化物研究
(1)一定条件下,将2molNO与2molO2置于恒容密闭容器中发生反应2NO(g)+O2(g)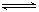 2NO2(g),下列各项能说明反应达到平衡状态的是 。
2NO2(g),下列各项能说明反应达到平衡状态的是 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.NO和O2的物质的量之比保持不变 d.每消耗1 molO2同时生成2 molNO2
(2)汽车内燃机工作时会引起N2和O2的反应:N2 + O2 2NO,是导致汽车尾气中含有NO的原因之一。在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如右图所示,根据图像判断反应N2(g)+ O2(g)
2NO,是导致汽车尾气中含有NO的原因之一。在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如右图所示,根据图像判断反应N2(g)+ O2(g) 2NO(g)的△H__________0(填“>”或“<”)。
2NO(g)的△H__________0(填“>”或“<”)。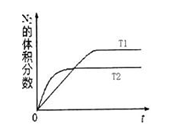
(3)NOx是汽车尾气中的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化如图所示: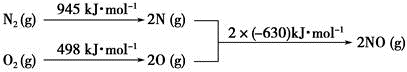
写出该反应的热化学方程式:________________________________。
Ⅱ.碳氧化物研究
(1)在体积可变(活塞与容器之间的摩擦力忽略不计)的密闭容器如右图所示,现将3molH2和2molCO放入容器中,移动活塞至体积V为2L,用铆钉固定在A、B点,发生合成甲醇的反应如下:CO(g)+2H2(g) CH3OH(g)。测定不同条件、不同时间段内的CO的转化率,得到如下数据:
CH3OH(g)。测定不同条件、不同时间段内的CO的转化率,得到如下数据: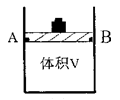
| CO的转化率 T(℃) |
10min |
20min |
30min |
40min |
| T1 |
20% |
55% |
65% |
65% |
| T2 |
35% |
50% |
a1 |
a2 |
①根据上表数据,请比较T1_________T2(选填“>”、“<”或“=”);T2℃下,第30min 时,a1=________,该温度下的化学平衡常数为_______________。
②T2℃下,第40min时,拔去铆钉(容器密封性良好)后,活塞没有发生移动,再向容器中通人6molCO,此时v(正)________v(逆)(选填“>”、“<”或“=”),判断的理由是 。
(2)一定条件下可用甲醇与CO反应生成醋酸消除CO污染。常温下,将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=_________________(用含a和b的代数式表示)。
氨气在工农业生产中有重要应用。
Ⅰ. (1)如下图所示,向NaOH固体上滴几滴浓氨水,迅速盖上盖,观察现象。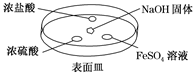
①浓盐酸液滴附近会出现白烟,发生反应的化学方程式为_____________________。
②FeSO4液滴中先出现灰绿色沉淀,过一段时间后变成红褐色,发生的反应包括Fe2++2NH3·H2O=Fe(OH)2↓+2NH和________________________。
(2)已知氨气极易溶于水,而难溶于有机溶剂CCl4。下列装置中不适宜做氨气尾气吸收的是 。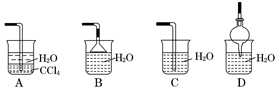
Ⅱ.现代传感信息技术在化学实验中有广泛的应用。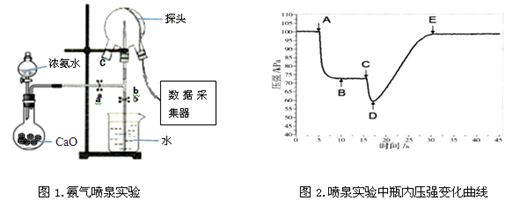
某小组用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理(图1)。
(1)关闭a,将吸有2mL水的胶头滴管塞紧颈口c,打开b,完成喷泉实验,电脑绘制三颈瓶内气压变化曲线(图2)。图2中 点时喷泉最剧烈。
(2)从三颈瓶中量取25.00mL氨水至锥形瓶中,加入 做指示剂;用0.0500 mol•L-1HCl滴定。终点时溶液颜色由 色变为 色,用pH计采集数据、电脑绘制滴定曲线如下图。
(3)据图,计算氨水的浓度为 mol•L-1;比较当VHCI=17.50ml时溶液中离子浓度大小关系 。
(4)关于该滴定实验的说法中,正确的是 。
| A.锥形瓶中有少量蒸馏水导致测定结果偏低 |
| B.酸式滴定管在滴定前有气泡,滴定后气泡消失测得氨水的浓度偏高 |
| C.酸式滴定管未用盐酸润洗会导致测得氨水的浓度偏高 |
| D.滴定终点时俯视读数会导致测得氨水的浓度偏低 |
已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性。从溶液中将Cu2+、Fe2+、Fe3+沉淀为氢氧化物所需pH分别为6.4,6.4,3.7。现有某氯化铜晶体中含有FeCl2杂质,为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按如图所示步骤进行提纯。
回答下列问题:
(1)最适合本实验的氧化剂是_____________。(填序号)
a.K2Cr2O7 b.H2O2 c.NaClO d.KMnO4
加入氧化剂对应的离子方程式为:_____________________________。
(2)物质Y是______________(填名称)。
(3)本实验加碱沉淀法能不能达到目的?______________原因是_________________________。
(4)最后能否直接蒸发结晶?若不能,应如何操作? _________________。
(5)加氧化剂的目的是__________________________。
(6)除去Fe3+的有关离子方程式_______________________________。
雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为2NO(g)+2CO(g) 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如下图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如下图所示。
据此判断:
①该反应的ΔH__________0(填“>”或“<”),ΔS__________0(填“>”或“<”)
②在T1温度下,0~2 s内的平均反应速率v(N2)=____________________。
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若增大催化剂的表面积,则CO转化率__________(填“增大”,“减少”或“不变”)
④若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是________________(填字母)。

(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
例如:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)ΔH=-867.0 kJ·mol-1
2NO2(g) N2O4(g)ΔH=-56.9 kJ·mol-1
N2O4(g)ΔH=-56.9 kJ·mol-1
写出CH4催化还原N2O4(g)生成N2和H2O(g)的热化学方程式_________________。
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。下图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。电极a、b表面发生的电极反应式分别为
a:_________________________________________;
b:_________________________________________。