(12分)A、B、C、D、E是相邻三个周期中的五种元素,它们的原子序数依次增大,B、C、D属同一周期,A 、E在周期表中处于同一纵行。己知:
①除A外,各元素原子的内层均已填满电子,其中B的最外层有4个电子;
②C的基态原子的2p能级的原子轨道中有2个未成对电子(单电子);
③D与E生成离子化合物,其离子的电子层结构相同。回答:
(1)A为 元素,B为 元素,C为 元素,D为 元素。
(2)C元素在周期表中属 周期 族元素,原子结构简图为 。
(3)用电子式表示D与E形成化合物的过程_______________________;写出E原子基态电子排布式 ______________ 。
(16分)氮及其化合物在化学实验中有广泛应用:
(1)请写出实验室用Cu和稀硝酸反应制备NO的离子方程式:;
(2)请设计实验,检验某可溶性固体物质中含有NH4+的操作、现象、结论:;
(3)实验室可用(NH4)2Cr2O7受热分解产生N2、Cr2O3和H2O来制备N2,请写出该分解反应的化学方程式:;
(4)有人发现重铬酸铵分解产物不仅含N2、Cr2O3和H2O,还含有NH3和O2,并指出伴随有显著的副反应发生:2(NH4)2Cr2O7 2Cr2O3+4NH3↑+2H2O+3O2↑;设计如下图所示实验装置,并通过实验方法验证了NH3和O2的存在(忽略空气中O2的干扰)。
2Cr2O3+4NH3↑+2H2O+3O2↑;设计如下图所示实验装置,并通过实验方法验证了NH3和O2的存在(忽略空气中O2的干扰)。
限选试剂:Na2S溶液、Na2SO3溶液、FeSO4溶液;
限选仪器:试管、玻璃导管、漏斗、烧杯、胶头滴管
①图中试管口玻璃纤维的作用是;
②根据实验目的,选择一种试剂和最佳的仪器补全该实验装置(在方框中画图并标注所选试剂);
③写出该法验证NH3和O2存在的实验原理的化学方程式:。
请你利用所学反应原理知识解决下列问题:
(1)若已知两个反应:①C(s)+2H2(g)=CH4(g) ΔH1=" a" kJ·mol-1 ;
②C(s)+ O2(g)=CO(g)ΔH2=" b" kJ·mol-1 ;
O2(g)=CO(g)ΔH2=" b" kJ·mol-1 ;
则2CH4(g)+O2(g)=2CO(g)+4H2(g)ΔH= (用含a、b的式子表示);
(2)碱性镁锰干电池是新开发的一种干电池,比普通锌锰干电池具有更加优越的性能,具有较大应用前景,其工作时总反应为:Mg+2MnO2+H2O=Mg(OH)2+Mn2O3;则工作时,正极发生 反应(填反应类型),写出负极的电极反应式: ;
(3)在一定温度下1 L的密闭容器放入足量草酸钙(固体所占体积忽略不计)发生反应:CaC2O4(s) CaO(s) +CO(g)+CO2(g),若前5 min 内生成CaO的质量为11.2 g ,则该段时间内v(CO)=;若某时刻达到平衡时c(CO2)= c;t0 时刻,将容器体积缩小为原来的一半并固定不变,在t1时刻再次达到平衡,请在下图中画出t0以后此体系中CO2的浓度随时间变化的图像;
CaO(s) +CO(g)+CO2(g),若前5 min 内生成CaO的质量为11.2 g ,则该段时间内v(CO)=;若某时刻达到平衡时c(CO2)= c;t0 时刻,将容器体积缩小为原来的一半并固定不变,在t1时刻再次达到平衡,请在下图中画出t0以后此体系中CO2的浓度随时间变化的图像;
(4)某温度下数据:草酸(H2C2O4)的K1=5.4×10-2,K2=5.4×10-5;醋酸的K=1.75×10-5;碳酸的 K1=4.2×10-7,K2=4.5×10-11;Ksp(CaC2O4) =5.0×10-9;Ksp(CaCO3) =2.5×10-9
①用醋酸溶液鉴别CaC2O4和CaCO3两种白色固体的实验现象是 ;
②向0.6 mol/L的Na2CO3溶液中加入足量 CaC2O4粉末后(忽略溶液体积变化),充分搅拌,发生反应:CO32-(aq) + CaC2O4(s) CaCO3(s)+ C2O42-(aq),静置后沉淀转化达到平衡,求此时溶液中的c(C2O42-)(不考虑其他诸如水解之类副反应,写出计算过程)。
CaCO3(s)+ C2O42-(aq),静置后沉淀转化达到平衡,求此时溶液中的c(C2O42-)(不考虑其他诸如水解之类副反应,写出计算过程)。
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。现就硫酸、硝酸与金属铜反应的情况,回答下列问题:
(1)工业上制备硫酸铜是利用废铜屑经灼烧后,在加热情况下跟稀硫酸反应,有关的化学方程式是:。
不采用铜跟浓硫酸反应来制取硫酸铜的原是。
(2)在一定体积的10 mol·L-1的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9 mol。则浓硫酸的实际体积(填“大于”、“等于”或“小于”)180 mL。
(3)若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为。
(4)将8 g Fe2O3投入到150 mL某浓度的稀硫酸中,再投入7 g铁粉,充分反应后,收集到1.68 L H2(标准状况),同时,Fe和Fe2O3均无剩余,为了中和过量的硫酸,且使溶液中铁元素完全沉淀,共消耗4 mol·L-1的NaOH溶液150 mL。则原硫酸的物质的量浓度为。
(6分)根据下表信息回答以下问题:
| 元素 |
A |
B |
C |
D |
E |
F |
G |
H |
| 原子半径(nm) |
0.130 |
0.118 |
0.090 |
0.102 |
0.073 |
0.154 |
0.037 |
0.099 |
| 主要化合价 |
+2 |
+3 |
+2 |
+6,-2 |
-2 |
+1 |
+1 |
+7,-1 |
部分短周期元素的原子半径及主要化合价
(1)将A、D、E、F、H对应的简单离子按照半径由小到大的顺序填空________________。
(2)B、H两元素的最高价氧化物所对应的水化物相互反应的离子方程式是____________________。
(3)实验室中制取H单质反应的化学方程式是______________________________。
已知可逆反应CO(g)+H2O(g) 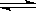 CO2(g)+H2(g),达到平衡时,K=
CO2(g)+H2(g),达到平衡时,K=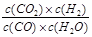 ,K是常数,只与温度有关,与浓度无关。
,K是常数,只与温度有关,与浓度无关。
(1)830K时,若起始时c(CO)="2" mol·L-1,c(H2O)="3" mol·L-1,平衡时CO的转化率为60%,水蒸气的转化率为;K值为。
(2)830 K时,若只将起始时c(H2O)改为6 mol·L-1,则水蒸气的转化率为。
(3)若830 K时,起始浓度c(CO)="a" mol·L-1,c(H2O)="b" mol·L-1,H2的平衡浓度c(H2)="c" mol·L-1①a、b、c之间的关系式是;②当a=b时,a=c。