要使垃圾中宝贵的再生资源得到充分利用,必须对垃圾进行分类。下图是一些地区采用的垃圾分类图标。
(1)图C的文字已模糊不清,从图中可以看出它表示的是
| A.可回收物 | B.可堆肥垃圾 | C.可燃垃圾 | D.有害垃圾 |
(2)上述各图中适宜于堆肥处理的垃圾是
(3)图D表示的垃圾若随意丢弃,会造成环境污染,这种污染通常称为 。
(4)图A废电池需要集中处理,主要原因是电池中含有的 掺入生活垃圾中进行填埋时,会通过渗液污染水体和土壤。
有A、B、C、D四种强电解质,它们均易溶于水,在水中电离时可产生下列离子:(每种物质只含一种阳离子和一种阴离子且互不重复)
| 阳离子 |
K+、Na+、Ba2+、NH4+ |
| 阴离子 |
CH3COO–、Cl–、OH–、SO42- |
已知:①A、C溶液的pH均大于7,B溶液的pH小于7,A、B溶液中水的电离
度几乎相同;D溶液焰色反应显黄色。
②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象。
(1)写出C溶液和D溶液反应的化学方程式:。
(2)25℃时pH = 9的A溶液和pH = 9的C溶液中水的电离程度较小的是(填写A或C的化学式)。
(3)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为。
(4)室温时在一定体积0.2 mol·L–1的C溶液中,加入一定体积的0.1 mol·L–1的盐
酸时,混合溶液的pH = 13,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C
溶液与盐酸的体积比是。
回答下列问题: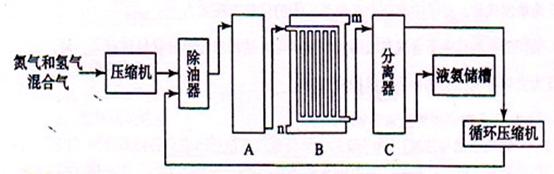
(1)工业合成氨的原料是氮气和氢气。氮气是从空气中分离出来的,通常使用的两种分离方法是 和将空气与碳反应后除去CO 2;氢气的来源是用水和碳氢化合物反应并产生CO, 写出采用天然气为原料制取氢气的化学反应方程式 。
(2)设备A中含有电加热器、触煤和热交换器,设备A中发生的化学反应方程式为 ;
(3) 设备B的名称是 ,其中m和n是两个通水口,入水口是 (填“m”或“n”)。
(4)设备C的作用 ;
(5)在原料气制备过程中混有CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:CO(g)+H2O(g)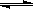 CO2 (g)+ H2 (g),已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于
CO2 (g)+ H2 (g),已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于
(计算结果保留三位有效数字)
在一定温度下的某容积可变的密闭容器中,建立下列化学平衡:
C(s)+H2O(g)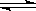 CO(g)+H2(g) , 试分析和回答下列问题:
CO(g)+H2(g) , 试分析和回答下列问题:
(1)可认定上述可逆反应在一定条件下已达到化学平衡状态的是。
| A.体系的压强不再发生变化 |
| B.v正(CO)=v逆(H2O) |
| C.生成n mol CO的同时生成n mol H2 |
| D.1 mol H-H键断裂的同时断裂2 mol H-O键 |
(2)若上述化学平衡状态从正反应方向开始建立,达到平衡后,缩小平衡体系的体积,则容器内气体的平均摩尔质量将(填“不变”、“变小”、“变大”)。
(3)若上述化学平衡状态从正、逆两反应方向同时建立[即起始时同时投放C(s)、H2O(g)、CO(g)、H2(g)],达到平衡后,试讨论:
① 容积内气体混合物的平均摩尔质量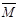 的取值范围是。
的取值范围是。
② 若给平衡体系加压,请参照起始投放的气体物质的平均摩尔质量(设定为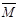 1),分别给出
1),分别给出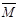 的变化:(填“增大”、“减小”、“不变”)
的变化:(填“增大”、“减小”、“不变”)
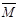 1的取值 1的取值 |
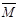 的变化 的变化 |
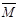 1<12 1<12 |
|
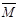 1=12 1=12 |
不变 |
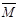 1>12 1>12 |
现用物质的量的浓度为a mol/L的标准盐酸去测定V mL NaOH溶液的物质的量浓度,请填写下列空白:
(1)酸式滴定管用蒸馏水洗净后,装入标准液前还应该进行的操作是。
(2)下图是酸式滴定管中液面在滴定前后的读数: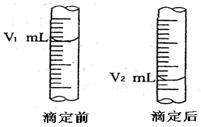
则c (NaOH) = (表达式)。
(3)若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的NaOH物质的量浓度会。(填“偏大”、“偏小”或不影响)
请你给出化合物A—K的结构简式。其中D的相对分子质量为100。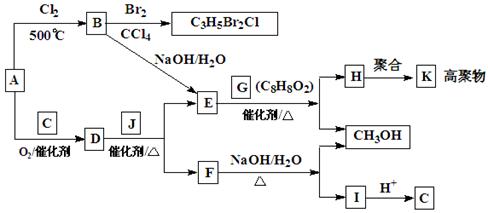
A 、B 、C、D、E、
F 、G、H、I 、G 、K .