下列离子方程式错误的是( )
| A.铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
| B.盐酸与氢氧化钡溶液:H++OH-=H2O |
| C.碳酸钙与稀硝酸:CaCO3+2H+=2Ca2++ CO2↑+H2O |
| D.硫酸铜溶液与氢氧化钡溶液:Cu2++SO42-+Ba2++2OH-=Cu(OH)2↓+BaSO4↓ |
下列有关结构和性质的说法中,正确的是
| A.因为酸性:HCl>H2CO3,所以非金属性:Cl>C |
| B.第ⅦA元素从上到下,其氢化物的稳定性逐渐增强 |
| C.同周期第ⅡA族与第IIIA族的元素原子序数之差不一定为1 |
| D.同周期主族元素的原子形成的简单离子电子层结构相同 |
下列说法正确的是
| A.在我们常用的元素周期表中,元素被划分为两类:金属元素和非金属元素 |
| B.在元素周期表中,每个纵列的价电子层的电子总数一定相等 |
| C.在元素周期表里,主族元素所在的族序数等于原子核外电子数 |
| D.在元素周期表中,s区,d区和ds区的元素都是金属元素 |
X、Y、Z三种元素的原子,其最外层电子排布为ns1,3s23p1和2s22p4,由这三种元素组成的化合物的化学式可能是
| A.X2YZ3 | B.X2YZ2 | C.X3YZ3 | D.XYZ3 |
下列叙述中,正确的是
| A.在一个基态多电子的原子中,可以有两个运动状态完全相同的电子 |
| B.在一个基态多电子的原子中,不可能有两个能量完全相同的电子 |
| C.在一个基态多电子的原子中,M层上的电子能量肯定比L层上的电子能量高 |
D.某基态原子错误的核外电子排布图为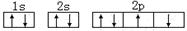 该排布图违背了泡利原理 该排布图违背了泡利原理 |
下列有关化学用语正确的是
| A.Fe的价层电子排布式是:3d64s2 |
B.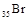 的电子排布式可简写为 的电子排布式可简写为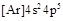 |
C.NH4Cl的电子式为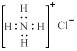 |
D.氯离子结构示意图为: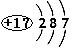 |