(1)某电解质溶液中,可能大量存在有Ag+、H+、CU2+、CO32-、OH-、Cl-离子,你认为一定有的离子是 ,一定没有的离子是 ;
(2)铜、铁、锌等质量合成的合金Wg,加入FeCl3和盐酸的混合液中,充分反应后:
①若无固体剩余,则溶液中的阳离子一定大量存在的 是 。
是 。
②若剩余固体为W/3g,则溶液中的阳离子一定大量存在的是 。
。
图中X、Y、Z为单质,其他为化合物,它们之间存在如下转化关系(部分产物已略去)。其中,A俗称磁性氧化铁:E是不溶于水的酸性氧化物,能与氢氟酸反应。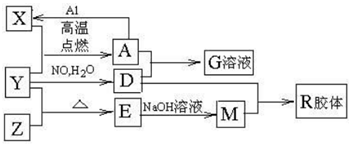
回答下列问题:
(1)组成单质Y的元素在周期表中的位置是 ;M中存在的化学键类型为 ;R的化学式是 。
(2)一定条件下,Z与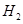 反应生成
反应生成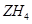 ,
,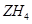 的电子式为 。
的电子式为 。
(3)已知A与1mol Al反应转化为X时(所有物质均为固体)。放出aKJ热量。写出该反应的热化学方程式: 。
(4)写出A和D的稀溶液反应生成G的离子方程式: 。
(5)问含4mol D的稀溶液中,逐渐加入X3粉末至过量。假设生成的气体只有一种,请在坐标系中画出n(X2-)随n(X)变化的示意图,并标出n(X2-)的最大值。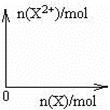
在温度t1和t2下,X2(g)和H2反应生成HX的平衡常数如下表:
| 化学方程式 |
K(t1) |
K(t2) |
F2+H2 2HF 2HF |
1.8×1036 |
1.9×1032 |
Cl2+H2 2HCl 2HCl |
9.7×1012 |
4.2×1011 |
Br2+H2 2HBr 2HBr |
5.6×107 |
9.3×106 |
I2+H2 2HI 2HI |
43 |
34 |
(1)已知t2>t1,HX的生成反应是________反应(填“吸热”或“放热”).
(2)HX的电子式是________.
(3)共价键的极性随共用电子对偏移程度的增大而增强,HX共价键的极性由强到弱的顺序是________.
(4)X2都能与H2反应生成HX,用原子结构解释原因:_________________________________________.
(5)K的变化体现出X2化学性质的递变性,用原子结构解释原因:_______________________________,原子半径逐渐增大,得电子能力逐渐减弱.
(6)仅依据K的变化,可以推断出:随着卤素原子核电荷数的增加,________(选填字母).
a.在相同条件下,平衡时X2的转化率逐渐降低
b.X2与H2反应的剧烈程度逐渐减弱
c.HX的还原性逐渐减弱
d.HX的稳定性逐渐减弱
X、Y和Z均为短周期元素,原子序数依次增大,X的单质为密度最小的气体,Y原子最外层电子数是其周期数的三倍,Z与X原子最处层电子数相同。回答下列问题:
(1)X、Y和Z的元素符号分别为 、 、 。
(2)由上述元素组成的化合物中,既含有共价键又含有离子键的有 、 。
(3)X和Y组成的化合物中,既含有极性共价键又含有非极性共价键的是 。
此化合物在酸性条件下与高锰酸钾反应的离子方程式为 ;此化合物还可将碱性工业废水中的CN-氧化为碳酸盐和氨,相应的离子方程式为 。
用Cl2生产某些含氯有机物时会产生副产物HC1。利用反应A,可实现氯的循环利用。
反应A: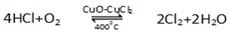
(1)已知:i反应A中,4mol HCI被氧化,放出115.6kJ的热量。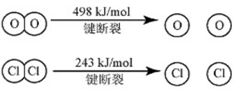
①H2O的电子式是_______________.
②反应A的热化学方程式是_______________。
③断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为________kJ,H2O中H—O键比HCl中H—Cl键(填“强”或“弱”)_______________。
(2)对于反应A,下图是4种投料比[n(HCl):n(O2),分别为1:1、2:1、4:1、6:1]下,反应温度对HCl平衡转化率影响的曲线。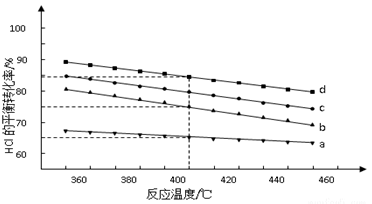
①曲线b对应的投料比是______________.
②当曲线b、c、d对应的投料比达到相同的HCl平衡转化率时,对应的反应温度与投料比的关系是_________________.
③投料比为2:1、温度为400℃时,平衡混合气中Cl2的物质的量分数是_______________.
选做【化学——物质的结构】在元素周期表中,除稀有气体外几乎所有元素都能与氢形成氢化物。氢化物晶体的结构有共价型和离子型之分。
(1)氨气是共价型氢化物。工业常用氨气和醋酸二氨合铜{[Cu(NH3)2]Ac}的混合液来吸收一氧化碳(醋酸根CH3COO-简写为Ac-)。反应方程式为:[Cu(NH3)2]Ac+ CO+NH3 [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac
①请写出基态Cu原子的电子排布式。
②氨水溶液中各元素原子的电负性从大到小排列顺序为。
③醋酸分子中的两个碳原子,甲基(—CH3)碳和羧基(—COOH)碳的杂化方式分别是。
④生成物[Cu(NH3)3CO]Ac中所含化学键类型有。
a.离子键b.配位键c.σ键d.π键
(2)某离子型氢化物化学式为XY2,晶胞结构如下图所示,其中6个Y原子(○)用阿拉伯数字1~6标注。
①已知1、2、3、4号Y原子在晶胞上、下面上。则5、6号Y原子均在晶胞。(填“侧面”或“内部”)
②XY2晶体、硅烷晶体和固态氨3种氢化物熔沸点高低顺序正确的是。
a.XY2晶体>硅烷晶体>固态氨b.XY2晶体>固态氨>硅烷晶体
c.固态氨>硅烷晶体>XY2晶体d.硅烷晶体>固态氨>XY2晶体